糖尿病大鼠视网膜和肾小球微血管病变的对比研究
中华眼科杂志 1999年第2期第35卷 论著
作者:魏玲格 王长龄 段惠军 张志勇
单位:050000 石家庄,河北医科大学第二附属医院眼科[魏玲格(研究生,现在该医院核医学科)王长龄],口腔内科(张志勇);河北医科大学病理教研室(段惠军)
关键词:糖尿病视网膜病;糖尿病肾病
【摘要】 目的 寻找糖尿病性视网膜病变(diabetic retinopathy ,DR)和糖尿病性肾病(diabetic nephropathy ,DN)两者间组织学改变的关系。方法 采用普通电镜和免疫组化电镜方法,并经电镜下定量分析视网膜和肾小球毛细血管基底膜的厚度及基底膜上负电荷位点的计数。结果 DR和DN的毛细血管基底膜呈逐渐增厚并伴有负电荷位点的减少。结论 DR和DN的发生、发展有其共同的形态学基础。DR和DN的微血管病变也有其不一致性。
Relationship between retinal and glomerular microvascular lesions in experimental diabetes in ratWEI Lingge, WANG Changling, DUAN Huijun, et al. Department of Ophthalmology, The Second Affiliated Hospital, Hebei Medical University, Shijiazhuang 050000
【Abstract】 Objective To evaluate the relationship between diabetic retinopathy (DR) and diabetic nephropathy (DN).Methods The thickness of retinal capillary basement membrane (RBM) and glomerular basement membrane (GBM) and their anionic sites were quantitatively analyzed by electron microscopy and immunohistochemical methods.Results RBM and GBM became gradually thickened with the development of diabetes. The thickened basement membrane was accompanied with decrease of anionic sites in number.Conclusion DR and DN share partly the pathological process, and there are also some incoordinate phenomena in the microvascular lesion.
【Key words】 Diabetic retinopathy Diabetic nephropathies
糖尿病性视网膜病变(diabetic retinopathy ,DR)和糖尿病性肾病(diabetic nephropathy ,DN)的研究在世界范围内倍受注目。然而有关的研究多集中于临床症状、分期及辅助检查结果的对比分析。而关于DR与DN之间的关系、两者的病理基础,特别是超微结构变化的异同,尚未见系统的对比研究。我们采用普通电镜和免疫组化电镜等方法对糖尿病动物模型进行了系统观察,着重对比分析视网膜和肾小球微血管病变,试图寻找DR和DN的相关性,以期阐明其发生、发展的规律,为临床探索或延缓糖尿病患者并发DR或DN的手段提供理论依据。
材料和方法
一、动物模型制备
SD大鼠40只, 雌雄各半, 体重120~170 g, 随机分为实验和对照组。实验组:28只大鼠,左下腹腔注射链脲佐菌素(美国Sigma公司产品)按55 mg/kg 体重诱发糖尿病。对照组:12只大鼠,同时左下腹腔注射等体积缓冲液。分别于注射后2周,1、3及6个月处死实验组动物7只, 对照组动物3只。动物处死前检测其尿糖、24 h尿蛋白量、血糖、肌酐和尿素氮。
二、电镜样品制备
大鼠处死后立即摘除眼球,迅速将视网膜组织切成1.5 mm×1.5 mm小片,肾皮质组织切成1 mm×1 mm×1 mm小块,戊二醛固定,逐级酒精脱水,树脂包埋,超薄切片,枸椽酸铅、醋酸铀双重染色,日立-H 600透射电镜下观察。
三、免疫组化电镜样品制备
首先将视网膜和肾皮质电镜标本用多聚亚胺染色,然后用戊二醛和磷钨酸液混合固定,以下步骤同普通电镜。电镜下观察视网膜毛细血管基底膜(retinal capillary basement membrane, RBM)和肾小球毛细血管基底膜(glomerular basement membrane ,GBM)负电荷位点的改变。
四、基底膜厚度的测量及基底膜上负电荷位点的计数
每份视网膜和肾脏电镜标本及免疫组化电镜拍摄的毛细血管照片各10张(30 000倍),选择基底膜垂直横断的区域,每个毛细血管选择10个点,每点数1 000 nm,求其平均数作为该毛细血管基底膜的厚度及该毛细血管每1 000 nm基底膜上负电荷位点的数目。
五、统计学处理方法
本文数据采用两样本均数比较的t检验法,进行统计学处理。
结果
一、生化指标
实验组注射后24 h、2周及1个月时血糖明显升高, 尿糖呈强阳性(+++); 3及6个月除上述变化外,其血肌酐、尿素氮及尿蛋白量均明显升高, 提示此时肾功能已有损害(表1)。
表1 不同病程的糖尿病大鼠生化检测指标
| 组别 |
例数 |
血糖
(x±s, g/L) |
肌酐
(x±s, g/L) |
尿素氮
(x±s, g/L) |
24小时蛋白尿
(x±s, g/L) |
尿糖 |
| 实验组 |
7 |
|
|
|
|
|
| 2周 |
|
260.0± 9.6 |
0.78±0.3 |
17.2±2.0 |
11.2± 0.5 |
+++ |
| 1个月 |
|
397.0±84.4 |
0.71±0.3 |
18.4±2.6 |
13.1± 0.8 |
+++ |
| 3个月 |
|
388.0±72.1 |
1.02±0.4* |
24.4±4.6* |
41.8± 8.5* |
+++ |
| 6个月 |
|
374.2±99.6 |
2.60±0.4* |
30.2±3.5* |
49.3±13.0* |
+++ |
| 对照组 |
3 |
|
|
|
|
|
| 2周 |
|
106.3±16.8 |
0.52±0.2 |
15.5±0.6 |
9.9± 0.7 |
- |
| 1个月 |
|
110.3±18.4 |
0.75±0.2 |
16.8±2.1 |
11.8± 0.5 |
- |
| 3个月 |
|
125.0± 6.2 |
0.81±0.2 |
13.7±1.9 |
13.1± 0.8 |
- |
| 6个月 |
|
119.3±16.8 |
0.60±0.2 |
13.7±1.9 |
12.5± 2.3 |
- |
*与对照组相比,P<0.05
二、电镜观察
实验组:(1)2周时见视网膜周细胞水肿、肥厚,线粒体肿胀、嵴消失或结构紊乱(图1)。至病程6个月时,毛细血管壁明显增厚,管腔狭窄。内皮细胞有微绒毛形成。部分区域基底膜劈裂成数层。两层基底膜之间由细胞外基质和胶原纤维样结构充填(图2)。从3个月起RBM明显增厚。(2)病程2周时,糖尿病大鼠肾小球系膜基质有增多倾向。1个月时,系膜基质增多伴系膜细胞增多。3个月时GBM增厚,系膜区域明显增宽且有系膜插入现象(图3)。6个月时,上述病变逐渐加重且有结节状病变形成(图4)。


图1 实验组,链脲佐菌素注射后2周视网膜毛细血管,示周细胞及线粒体水肿 ×1000图2 链脲佐菌素注射后6个月视网膜毛细血管,示RBM明显增厚,纤维样物质增多 ×1000


图3 链脲佐菌素注射后3个月肾小球,示膜区域明显增宽 ×5000图4 链脲佐菌素注射后6个月肾小球,示膜区域致密沉积物 ×7500
对照组:(1)大鼠视网膜毛细血管壁可见内皮细胞、周细胞及基底膜。有周细胞的区域基底膜分为两层(图5)。(2)大鼠肾小球毛细血管由内皮细胞、基底膜和上皮细胞组成。毛细血管之间为系膜区域,包括系膜细胞和系膜基质(图6)。


图5 对照组大鼠视网膜毛细血管 ×10000图6 对照组大鼠肾小球毛细血管 ×6000
定量分析表明RBM和GBM均随病程发展而增厚,实验组与对照组比较,经t检验,差异有显著性(P<0.01)(表2)。
表2 两组不同时期糖尿病大鼠视网膜和肾小球毛细血管基底膜厚度的改变
| 组别 |
视网膜厚度(x±s,nm) |
肾小球厚度(x±s,nm) |
| 2周 |
1个月 |
3个月 |
6个月 |
2周 |
1个月 |
3个月 |
6个月 |
| 实验组 |
97.6± 9.6 |
97.6±17.6 |
248.3±14.2 |
318.6±23.4 |
157.4± 9.6 |
173.1±13.4 |
293.8±17.2 |
399.8±26.9 |
| 对照组 |
97.4±13.0 |
83.2±19.5 |
203.5±16.3 |
236.3±20.7 |
148.2±11.2 |
161.6±12.8 |
197.8±15.3 |
189.3±20.1 |
| t值 |
0.024 |
1.096 |
4.109 |
5.571 |
1.232 |
1.287 |
8.806 |
13.867 |
| P值 |
>0.05 |
>0.05 |
<0.01 |
<0.01 |
>0.05 |
>0.05 |
<0.01 |
<0.01 |
三、RBM和GBM负电荷位点的改变
实验组:大鼠随病程的发展至6个月时,无论是RBM还是GBM,其外疏松层的多聚亚胺染色颗粒数量均明显减少,即颗粒的间距显著加大,并可见颗粒丢失现象(图7,8)。实验组与对照组比较,差异有显著性(P<0.01)(表3)。

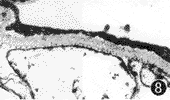
图7 链脲佐菌素注射后6个月RBM,示RBM负电荷位点减少 ×25000图8 链脲佐菌素注射后6个月GBM,示GBM负电荷位点减少 ×20000
表3 两组不同时期糖尿病大鼠视网膜和肾小球基底膜外疏松层阴离子位点变化比较
| 组别 |
视网膜位点(x±s,个/1 000 nm) |
肾小球位点(x±s,个/1 000 nm) |
| 1个月 |
3个月 |
6个月 |
1个月 |
3个月 |
6个月 |
| 实验组 |
16.1±1.5 |
14.8±1.2 |
10.4±1.9 |
18.8±1.4 |
17.0±1.6 |
13.5±1.3 |
| 对照组 |
16.3±1.7 |
15.2±1.0 |
15.4±1.7 |
20.2±1.4 |
19.2±2.0 |
18.3±1.7 |
| t值 |
0.175 |
0.550 |
4.135 |
1.449 |
1.671 |
4.322 |
| P值 |
>0.05 |
>0.05 |
<0.01 |
>0.05 |
>0.05 |
<0.01 |
对照组:大鼠RBM和GBM的外疏松层可见排列较规则的多聚亚胺染色颗粒大小较一致,多聚亚胺染色颗粒代表负电荷位点存在的区域,负电荷位点主要由硫酸类肝素多糖蛋白构成(图9,10)。与RBM相比,GBM上的多聚亚胺染色颗粒数量多、分布密度大。
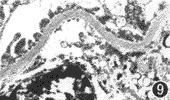
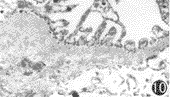
图9 对照组RBM负电荷位点分布情况 ×25000图10 对照组GBM负电荷位点分布情况 ×20000
讨论
一、本研究目的
如何预防或延缓DR和DN的发生、发展是关系到能否进一步延长糖尿病患者的生存时间、提高生存质量的重要课题。围绕这一课题人们进行了大量研究。许多学者从临床不同角度探讨了DR和DN之间的关系[1-4]。本研究旨在应用电镜和免疫组化电镜技术,对比分析视网膜和肾小球微血管在糖尿病不同时期的连续变化,进一步探讨DR和DN发生、发展的规律及相互关系。
二、DR和DN的发生、发展具有共同的形态学基础
DR和DN的发病机制是否一致,两者间是否有因果或相互影响关系,一直是人们十分关注的问题。本研究结果提示,DR和DN的发生发展有其共同的形态学基础。DR主要表现为周细胞的退行性变,毛细血管基底膜增厚及内皮细胞增殖等重要结构改变。而毛细血管基底膜的增厚是DR和DN共有的病变。定量分析表明,RBM从病程3个月起开始增厚,6个月时增厚明显。GBM同期发生了相同的改变。普通电镜和免疫组化电镜证实,随着病程的发展RBM和GBM均可增厚,而它们的增厚均伴有硫酸类肝素多糖蛋白构成的负电荷位点的减少。负电荷位点被认为与毛细血管壁的通透性密切相关。在GBM上的负电荷位点构成毛细血管壁的电荷选择屏障,可有效地阻止带负电荷的血清蛋白的漏出[5,6]。这种减少有利于带负电荷的血清蛋白等穿过基底膜,推测这可能与DR时毛细血管壁通透性增加、渗出性病变的发生有一定关系。本研究结果显示肾功能的改变与RBM和GBM增厚及负电荷位点减少呈平行关系,这不仅提示DR和DN具有相关性,且证实,两者基底膜及其构成成分的改变有其共同的形态学基础,对DR和DN的发生、发展具有重要的意义。
三、DR和DN的不一致性
然而,DR和DN的微血管病变也有其不一致性,病程2周时DR表现为周细胞水肿、线粒体肿胀,嵴消失等;而DN则表现为肾小球系膜基质的增多,上皮细胞的病变较轻。DR和DN晚期均可引起毛细血管的硬化,其硬化机制则不一致。DN的肾小球硬化,其构成成分均为增厚的基底膜和增多的系膜基质,无胶原纤维样物质;而DR的视网膜毛细血管壁除基底膜增厚外,还可见大量胶原纤维样物质参与其硬化过程。
我们从形态学角度探讨了DR和DN两者在发生发展中的相互关系,且细胞结构改变出现较早,提示DR、DN的临床症状出现前,可能已有亚临床的改变。因此,临床应重视糖尿病的早期诊断、早期治疗,以减少和延缓DR、DN并发症的发生和恶化。
参考文献
1 徐灵星,陈振谦,余爱琴.糖尿病性视网膜病变与肾功能的关系(96例分析).实用眼科杂志,1993, 11:135-136.
2 Lugari R, Scoccianti L, Tagliavini P, et al. Renal involvement in different conditions of severe diabetic retinopathy. Med Sci Res, 1992,20:467-470.
3 Chavers BM, Mauer SM, Ramsay RC, et al. Relationship between retinal and glomerular lesions in IDDM patients. Diabetes, 1994, 43:441-446.
4 Osterby R, Gall MA, Schmitz A, et al. Glomerular structure and function in proteinuric type I (non-insulin-dependent) diabetic patients. Diabetologia, 1993, 36:1064-1070.
5 Kanwar YS, Farquhar MG. Anionic sites in the glomerular basement membrane:in vivo and in vitro localization to the Laminae rarae by cationic probes. J Cell Biol, 1979, 81:137-153.
6 Kanwar YS, Linker A, Farquhar MG. Increased permeability of the glomerular basement membrane to ferritin after removal of glycosaminoglycans (heparan sulfate) by enzyme digestion.J Cell Biol,1980, 86:688-693.
(收稿:1998-04-23 修回:1998-11-30)