白血病抑制因子受体中gp130细胞内区诱导白血病细胞Meg-01内c-myc的表达
第二军医大学学报2000年第21卷第6期
刘厚奇 汤淑萍 刘善荣 胡世杰 傅继梁
摘 要 目的:观察人白血病细胞系Meg-01白血病抑制因子(LIF)受体α亚基(gp190)和另一亚基gp130细胞内区与c-myc的关系,以探明白血病细胞过度增殖和晚期分化异常的机制。方法:用基因重组技术将两基因细胞内区互换以构成两嵌合体受体(190/130,130/190),并分别在Meg-01表达,其与野生型受体竞争性结合LIF,用免疫组化和蛋白质印迹法分析受体细胞内区形成同源性二聚体(190cyt-190cyt,130cyt-130cyt)后的细胞状况和细胞内c-myc的表达。结果: 转染pED 190/130后用LIF作用 6 h,Meg-01细胞c-myc表达量增加,细胞增殖明显;而另一嵌合体受体对Meg-01细胞c-myc的表达无影响。结论:LIF受体中gp130亚基的细胞内区参与白血病Meg-01细胞内增殖信号的传递。
关键词:白血病;抑制因子,免疫;受体;信号传导
白血病抑制因子(LIF)是一种多功能的细胞因子,可调节多种细胞的生物活性,如抑制胚胎干细胞分化,维持垂体功能,促进成骨细胞增殖,参与神经肌肉修复,刺激血小板生成等[1]。这些生物效应均有赖于其结合靶细胞膜上的LIF受体α亚基(gp190),并使之与另一亚基(gp130)形成异源性二聚体[2],从而使细胞内一系列信号分子发生变化[3]。然而,最初得其名却是因为该因子可抑制鼠白血病细胞M1的增殖。同时,多种白血病细胞普遍存在着c-myc原癌基因的高水平表达并引起白血病细胞的过度增殖。进一步研究发现,c-myc在G0/G1期表达水平下降,而G1期表达水平上升[4]。那么, lIF抑制白血病细胞的增殖与c-myc是何种关系?LIF受体两亚基的细胞内区各自有何作用?尚不明了。本研究用基因重组技术将两基因细胞内区互换以构成两嵌合体受体(190/130,130/190),并分别在Meg-01表达,因其可与野生型受体竞争性结合LIF,故可分析受体细胞内区形成同源性二聚体(190cyt-190cyt,130cyt-130cyt)后各细胞内区是否参与细胞增殖相关基因c-myc表达水平的调节,以确定两亚基在白血病细胞增殖和分化中的作用。
1 材料和方法
1.1 细胞株 人Meg-01细胞株由上海第二军医大学长海医院血液科周红医师提供,该细胞株用含15%小牛血清的 iMDM (Gibco)37℃,5% CO2 条件下培养。
1.2 LIF受体两亚基细胞内区的互换 以pKCSRα gp190 (LIF 受体α亚基)和pRclgo gp130(Moreau 博士提供)为模板,分别以SalⅠ,BamHⅠ和SalⅠ/XhoⅠ,XbaⅠ酶切并装入pALTER。合成引物1(5′CCATTCTCGTTTTCTAGAGCAAAGGAT3′)和引物2(5′GTCTCGCTTTCTAGAGCAGAACAGCAC 3′),并用Altered sites Ⅱ突变系统(Promega)分别使两亚基的跨膜区与细胞内区之间产生XbaⅠ。然后,用XbaⅠ和BamHⅠ取下各自细胞内区并进行互换成190/130和130/190。最后以PstⅠ,EcoRⅠ及 pstⅠ,SmaⅠ将两亚基嵌合体从pALTER移至表达载体pED (Moreau博士提供)。
1.3 LIF受体两亚基嵌合体基因的Meg-01细胞转染 含190/130,130/190嵌合体基因的逆转录病毒载体pED(pED190/130,pED 130/190) 用脂质体转染法(Gibco-BRL公司的LipofectamineTM和操作步骤)分别转染于Meg-01。同时,让嵌合体与绿色荧光蛋白(GFP)表达载体 pEGFP-N1 (Clontech)共转染以判断脂质体的转染效果。48 h后加入100~500μmol/L氨甲蝶呤(Sigma)和500 mg/ml G418(Sigma)筛选4周。100~250μg/ml LIF[5]作用 6 h后收集细胞。
1.4 蛋白质印迹分析嵌合体和c-myc的表达 用冷冻PBS将细胞洗两次,然后按1×107个细胞加100μl TBS(pH 7.4, 20 mmol/L Tris- HCl,150 mmol/L NaCl,1 mmol/L EDTA)含1% triton X-100的 200 μmol/L 苯甲基磺酰氟(PMSF,Sigma)、 2 μmol/L亮肽素(leupeptin,华顺试剂公司)、2 μmol/L 抑肽酶(aprotinin,华顺试剂公司),在冰上反应20 min后,4 ℃, 1.2×104 r/min 离心20 min。 上清经15% SDS-PAGE凝胶电泳,用槽式转膜仪(TE52X pharmacia Biotech)将蛋白转移到PVDF膜(聚偏二氟乙烯,Whatman)。让抗gp190 igG,抗gp130 IgG(Santa Cruz) 和9E10分别与膜蛋白结合,AKP标记的抗兔IgG和抗鼠IgG分别与一抗结合,BCIP/NBT作为酶底物显色。
1.5 免疫组化检测c-myc基因的表达 用冷冻PBS将细胞洗两次,接着浸入1.6%甲醛中固定30 min,均匀涂布于覆有铬明矾明胶的载玻片上,37℃过夜。检测前将涂有细胞的载玻片重新固定20 min,然后用PBS洗3次。滴加正常羊血清封闭20 min,抗myc单克隆抗体9E10(Pharmagene)37℃反应40 min,AKP标记兔抗鼠IgG(Promega)在同等条件下与细胞孵育。随后浸泡于碱性磷酸酶缓冲液(pH9.5)5 min,并用 BCIP/NBT使之显色。显微镜观察细胞显色适当后,用自来水冲洗、烘干、中性树胶封片。生物显微图像分析系统(复日,FR-988 smart Scape 2000)摄相、标记、分析。
1.6 统计学处理 用χ2检验处理细胞数量变化的数据,用t检验处理c-myc表达变化和细胞体积差异的数据。
2 结 果
2.1 LIF受体嵌合体190/130,130/190 cDNA 的克隆 用Altered SitesⅡ突变系统按设计在gp190,gp130的跨膜区和细胞内区间产生的限制性内切酶位点经XbaⅠ酶切证实,两亚基的细胞外区跨膜区及细胞内区基因分别用全自动DNA测序仪(ABI pRISM 373A)分析均正确无误。
2.2 LIF受体嵌合体190/130,130/190 cDNA的转染 用脂质体将pED190/130,pED130/190分别与pEGFP-N1共转染于Meg-01细胞。氨甲蝶呤和G418筛选4周后,用荧光显微镜观察GFP表达的成活细胞占65%~80%,证实嵌合体转染成功。
2.3 蛋白质印迹分析嵌合体以及野生型受体的表达 从图1可以看出,两嵌合体已分别在Meg-01细胞表达。野生组和两嵌合体组也可见gp190亚基特别是gp130亚基的表达,但表达量远低于嵌合体,符合嵌合体与野生型受体竞争性结合LIF的要求。
2.4 蛋白质印迹分析c-myc的表达 c-myc在Meg-01细胞中有明显表达(图2的对照组),实验组中190/130组的c-myc表达较130/190组为高,130/190组与对照组差别不大(图2)。
2.5 免疫组化检测c-myc基因的表达 加入100~250 ng/ml LIF与细胞表面的野生型LIF受体亚基和嵌合体130/190,190/130结合而分别形成二聚体(190cyt-190cyt,130cyt-130cyt),观察各组细胞内c-myc表达水平。结果发现c-myc表达对照组与190/130组比较差异非常显著(P<0.001),而与130/190之间无差异(图3)。实验证明,130细胞内区形成二聚体时可促进c-myc的表达。

图 1 蛋白质印迹分析转染嵌合体cDNA后
meg-01内嵌合型受体的表达
fig 1 Expression of each chimeric receptor in Meg-01
transfected with 190/130 or 130/190
a: Group 190/130; B: Group 130/190;
c: Meg-01 cell; D: Protein marker

图 2 蛋白质印迹分析转染pED,pED190/130和
pED 130/190的Meg-01细胞中c-myc的表达
fig 2 Analysis of c-myc level in Meg-01 cell
transfected with pED, pED 190/130 or pED
130/190 with immunoblotting
a: Control Group; B: Group 190/130; C: Group 130/190
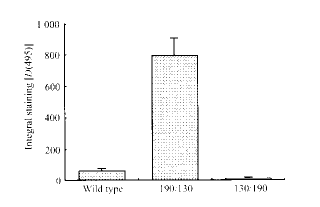
图 3 LIF作用于嵌合型受体时c-myc的表达水平
fig 3 Expression level of c-myc in Meg-01 cell with the
chimeric receptor after LIF stimulation
2.6 细胞体积和细胞计数 用LIF作用于转染嵌合体190/130的细胞,6 h后细胞直径为(47.6±2.3) μm,与对照组比较,差异非常显著(P<0.01),130/190组与对照组比较无显著变化。继续培养72 h后,对照组,190/130组和130/190组细胞计数(1×106):未用LIF时分别为13.2±2.8,12.1±1.2和12.3±3.4;而用LIF后分别为5.5±1.7,10.5±3.6和6.8±0.8,190/130组较对照组增加96%,差异非常显著(P<0.001),对照组与130/190组之间无显著差异。结果表明,gp130细胞内区参与了细胞增殖信号的传递。
3 讨 论
LIF的生物效应是通过结合靶细胞上的LIF受体α亚基(gp190),并使之与IL-6信号传导子(gp130)形成异源性二聚体,从而启动细胞内一系列信号分子的活性,以完成LIF的信息从细胞膜至细胞核的传递,使细胞产生一系列生理或病理的变化[3]。然而,这些效应的“开关”点基本上取决于LIF受体两亚基细胞内区的蛋白质一级结构以及形成异源性二聚体后蛋白质三级结构。如LIF受体α亚基和gp130均存在着与细胞增殖和分化相关的3个结构功能域 box1 Box2 Box3的含酪氨酸(Tyr)的基元YXXQ(Y为酪氨酸,Q为谷氨酰胺,X为任意氨基酸)。虽然受体本身不存在蛋白激酶区域(即谓之非受体酪氨酸激酶受体家族),但是,二聚体形成结构的变化,使JAK(一类酪氨酸激酶)能够将LIF受体两亚基上的Tyr磷酸化。从此,“开关”便在“开”的状态[6]。随之形成“瀑布”效应,包括 sTATS,MAPK,Fes,Btk,Tec激酶及PIP1D磷酸酶的相互诱导和调节,最终使c-myc,c-myb,JunB,IRF1以及 stat3转导活性改变,细胞进行增殖和分化[3]。
细胞中c-myc的表达一般认为与其细胞的增殖有关,并初步判定各种myc的异常为肿瘤细胞发生和发展的原因之一[7]。为了探明gp190,gp130细胞内区分子结构对LIF刺激引起的“开关”作用的影响,以确定两亚基在白血病细胞增殖和分化中的地位,我们构建两嵌合体受体亚基(190/130,130/190)并分别在Meg-01表达。LIF与野生型受体亚基(gp190或 gp130)及嵌合体受体亚基(130/190或190/130)结合,使受体细胞内区形成同源性二聚体(190cyt-190cyt,130cyt-130cyt)后,分析LIF受体两亚基的细胞内区各自与细胞内c-myc表达的关系。结果表明,gp130细胞内区为同源二聚体时可使细胞内c-myc的表达较野生组为高(见图2,3),而gp190细胞内区无此效应。尽管同源性二聚体在空间结构上有别于LIF野生型受体的异源性二聚体,但两亚基细胞内区近膜的两个结构功能域均位于第70位氨基酸以内,只是第3个结构功能域的位置与膜的距离不同和细胞内区长度存在差异(gp190为238AA,gp130为277AA)[3]。所以,同源二聚体的空间结构变化主要体现在两亚基第3个功能结构域位置不同上。可以看出,gp130细胞内区远膜段对c-myc的表达起调节作用。
许多实验证实,c-myc 可促进细胞DNA和蛋白质的合成,特别是c-myc激活转录起始因子eIF4E而参与细胞增殖功能[8]。另外,c-myc诱导 cyclin E/ Cdk2(cyclin-dependent kinase 2) 形成复合物,并 对Cdk抑制物 p27KIP1有拮抗作用[9],表明其促进细胞从静止期进入分裂期。本研究也证明LIF作用6 h后,c-myc 表达高的190/130组细胞体积较对照组为大,且72 h后细胞增殖速度较野生组快。这一切表明c-myc与细胞增殖有关,并由gp130细胞内区诱导。Meg-01为巨核白血病细胞系,LIF是巨核细胞晚期分化成熟的主要诱导因子[10]。LIF受体的两亚基在信号传导方面有着不同的作用[11]。本研究也发现gp190和gp130在诱导c-myc的功能方面存在差异。我们推测LIF诱导巨核细胞晚期分化可能是通过gp190传导信息的。
【基金项目】国家自然科学基金资助项目(39680012)
【作者简介】刘厚奇(1957~),男(汉族),副教授,硕士 生导师【作者单位】刘厚奇(第二军医大学基础医学部组织胚胎学教研室,上海20 0433)
汤淑萍(第二军医大学基础医学部组织胚胎学教研室,上海20 0433)
刘善荣(第二军医大学基础医学部组织胚胎学教研室,上海20 0433)
胡世杰(第二军医大学基础医学部组织胚胎学教研室,上海20 0433)
傅继梁(医学遗传学教研室)
参考文献
[1] Metcalf d. The leukemia inhibitory factor[J]. Intern J Cell Cloning, 1991,9(2):95-108.
[2] Gearing DP ,Thut CJ, VandaBos T, et al. Leukemia inhibitory factor receptor is structurally related to the IL-6 signal transducer gp130[J].EMBO j,1991,10(10):2839-2848.
[3] 刘厚奇,傅继梁.白血病抑制因子受体与细胞内信号分子[J].国外医学*分子生物学分册,1998,20(6):166-169.
[4] Einat M, Resnitzky D, Kimchi A. Close link between reduction of c-myc expression by interferon and G0/G1 arrest[J]. Nature,1985,313(6003):597-600.
[5] Zhu K, Liu H ,Liu XP, et al. Cloning and expression of leukemia inhibitory factor in CHO cell line and its inhibitory effect on the proliferation of U937[J]. J Exp Hematol,1998,6(2): 190-193.
[6] Yamanake Y, Nakajima K, Fukada T,et al. Differentiation and growth arrest signals are generated through the cytoplasmic region of gp130 that is essential for Stat3 activation[J]. EMBO J, 1996, 15(6):1557-1565.
[7] Nesbit CE, Tersak JM, Prochownik EV. MYC oncogenes and human neoplastic disease[J]. Oncogene, 1999, 18(19):3004-3016.
[8] Schmidt EV. The role of c-myc in cellular growth control[J].Oncogene,1999,18(19):2988-2996.
[9] Obaya AJ, Mateyak MK, Sedivy JM. Mysterious liaisons: the relationship between c-myc and the cell cycle[J]. Oncogene, 1999,18(19):2934-2941.
[10] Quentmeier H, Zaborski M, Graf G, et al. Expression of the receptor mPL and proliferative effects of its ligand thrombopoietin on human leukemia cells[J]. Leukemia, 1996,10 (2):297-310.
[11] Starr R, Novak U, Willson TA, et al. Distinct roles for leukemia inhibitory factor receptor α-chain and gp130 in cell type-specific signal transduction[J]. J Biol Chem, 1997, 272(32):19982-19986.