α-双炔失碳酯诱导人早幼粒白血病HL-60细胞分化
中国肿瘤临床1999年第26卷第10期
楼丽君 胥彬
摘 要 目的:研究α-双炔失碳酯(α-anordrin,ANO)对人早幼粒细胞白血病HL-60细胞的分化诱导作用。方法:细胞生长用台盼蓝排染法;细胞分化根据细胞形态,酸性磷酸酶活性来决定;细胞周期变化用流式细胞光度术;细胞特异性抗原的表达用免疫细胞化学方法。结果:HL-60细胞经ANO(2~8μmol/L)处理96小时后,细胞生长受到明显抑制,抑制率达90%。同时,细胞核缩小,核浆比例增大,酸性磷酸酶活性呈剂量依赖性地升高,提示细胞向粒-巨细胞系分化。流式细胞仪检测发现ANO处理使G1期细胞比例增加。细胞免疫化学分析则表明ANO处理使PCNA表达下降,雌激素受体表达升高,而对c-myc表达没有影响。结论:以上结果说明ANO能够诱导HL-60细胞分化,这一作用可能与其通过雌激素受体,阻滞细胞周期进展,抑制PCNA表达有关。
关键词:α-双炔失碳酯 增生细胞核抗原 雌激素受体 细胞分化
在体外模型上,能够诱导肿瘤细胞终末分化的药物很多,如维甲酸类化合物,1,25-二羟维生素D3,干扰素,佛波酯,平面极性化合物,细胞毒药物,环AMP调节剂及类似物等[1,2],但真正能够应用于临床并产生良好疗效的,目前只有全反式维甲酸(ATRA)。ATRA也有局限性,如只对急性早幼粒细胞白血病有效,对其它肿瘤无效;长期应用,容易产生抗药性等,因此,寻找新的分化诱导剂仍有十分重要的意义。
α-双炔失碳酯(α-anordrin,ANO)是我国自行研制、开发的避孕药物,我们实验室发现ANO能够阻滞细胞周期进展,抑制肿瘤细胞生长,诱导肿瘤细胞凋亡,增效5-FU,放线菌素D,长春新碱的疗效,对体内、外多种肿瘤模型有效[3~5]。本文研究了ANO对人早幼粒细胞白血病HL-60细胞分化的影响。
1 材料与方法
1.1 药物和试剂
双炔失碳酯购自上海第十九制药厂,含α和β异构体,α异构体由本所植化室从中分离,纯化[6]。α-双炔失碳酯(ANO)用无水乙醇溶解,临用前稀释,培养基中乙醇终浓度不高于0.1%,在此浓度下,乙醇对细胞生长不产生明显影响。ATRA,磷酸对硝基苯,购自Sigma公司。ATRA用无水乙醇溶解,临用前稀释。小鼠抗PCNA(proliferating cellnuclear antigen)单克隆抗体(M0879)为DAKO公司产品。小鼠抗人雌激素受体(ER)单克隆抗体购自华美生物工程公司。
1.2 细胞培养和药物处理
收集对数生长的细胞,调细胞数为1×108/L-1,用ANO或ATRA处理96小时后,观察细胞分化情况。实验重复两次。
1.3 生长曲线测定
0,24,48,72,96小时取少量细胞悬液计数,用台盼蓝染料排除法。
1.4 形态学观察
药物处理后,将细胞离心,涂片,Wright染色,油镜下观察形态变化。
1.5 酸性磷酸酶活性测定
收集细胞,悬浮于40μl蒸馏水中,超声粉碎2分钟,然后加入0.4ml 38mmol/L的柠檬酸缓冲液(pH4.8含0.1%TritonX-100,4.2mmol/Lρ-磷酸对硝基苯),37℃下,温育15分钟,加入0.8ml1mol/LNaOH终止反应。在410nm波长处测OD值标准由线用对硝基苯制作,酸性磷酸酶活力以μg/105细胞/分表示。
1.6 DNA含量分析
参照Gong等人的方法[7]略加改进。即细胞用PI代替DAPI进行染色单因素分析。每个样本用FACStarplus流式细胞仪检测8000个细胞,根据DNA含量频率分布直方图计算各时相细胞百分比。
1.7 免疫细胞化学染色
细胞涂片,用丙酮固定,单抗的稀释度参照试剂盒说明,作不同浓度稀释,然后确定一最高信/噪比的稀释度。空白对照不加单抗。
2 结果
2.1 细胞生长
从图1可以看出,ANO明显抑制HL-60细胞生长,呈浓度和时间依赖性。当ANO浓度8μmol/L时,抑制率高达90%,IC50约为5.2μmol/L。对照药物ATRA对HL-60细胞生长也有抑制作用,IC50约为5.2μmol/L。

图1ANO(2~8μmol/L)对HL-60细胞生长影响的浓度和时间依赖性n=3,X±s**与对照比较P<0.01<P>
2.2 细胞形态
未经药物处理的HL-60细胞呈圆形或椭圆形,胞核大而圆,核浆比例较大,经ANO2μmol/L(<IC10)处理后,核浆比例减小,核仁减少或消失,胞核呈肾形或有较大切迹(图2),提示细胞向成熟表型分化。同样条件下,ATRA1μmol/L(<IC10)处理4天,也能够诱导HL-60细胞分化(图2)。
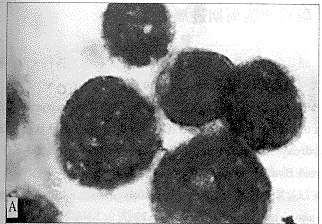


图2ANO对HL-60细胞形态的影响A:对照;B:ANO2μmol/L;
c:ATRA1μmol/LWright′s染色×1000
2.3 酸性磷酸酶活性
酸性磷酸酶是巨噬细胞的标记酶之一,其含量的高低可反映细胞的成熟程度。ANO(2~8μmol/L)作用96小时,ANO剂量依赖性地使HL-60细胞的酸性磷酸酶活性升高(图3)。

图3ANO(2~8μmol/L)作用96小时对HL-60细胞酸性磷酸酶活性的影响n=3,X±s**与对照比较P<0.01
2.4 细胞周期分析
未加药物处理的HL-60细胞,细胞主要分布在S期,占52%;其次分布在G1期,占42%;只有少部分细胞分布在G2/M期,占6%。经ANO(2~8μmol/L)处理后,G1期细胞呈剂量依赖性的上升,而S期细胞相应地减少。当ANO为8μmol/L时,G1期细胞从42%上升到63%(P<0.01),而S期细胞则从52%减少到32%。ANO对G2/M期的细胞分布影响较少。ATRA也有相似的作用,但对G1期细胞的阻滞作用比ANO强。
2.5 免疫细胞化学检测
PCNA表达程度与细胞增生密切相关。PCNA表达较高的细胞,往往增生较快。相反,细胞增生较慢,并且趋向于分化,对照的HL-60细胞PCNA阳性率高达40%,ANO(2μmol/L,96小时)处理后下降到8%。考虑到ANO引起的PCNA表达下降有可能是非特异性细胞抑制作用所致,本文进一步观察了ANO对HL-60细胞c-myc的影响,发现ANO处理并不能使c-myc蛋白的表达水平发生明显改变。结果提示ANO抑制PCNA表达具有一定的特异性(图4A,B)。

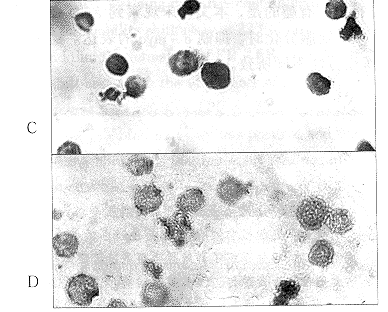
图4ANO处理96小时对PCNA(A,B)和ER(C,D)表达的影响
a,C:对照;B,D:ANO2μmol/L×400
以前研究表明ANO具有一定程度的雌激素拮抗作用。因此,本文研究了ANO对HL-60细胞ER表达的影响。未经处理的HL-60细胞ER主要分布于胞浆,经ANO2~8μmol/L处理96小时后,HL-60细胞胞浆、胞核的ER免疫染色均增强,表明ANO处理不但使HL-60细胞的ER表达,并且使ER出现核转位。ER核转位是ER活化的标志之一,提示ER可能在ANO诱导HL-60分化中起重要的作用(图4C、D)。合用ER激动剂雌二醇,不但消除ANO对ER表达的上调作用,而且明显抑制ANO诱导HL-60细胞分化。进一步证实了ER是ANO诱导HL-60细胞分化的重要介导成分。
3 讨论
本实验表明ANO(2~8μmol/L)能够抑制早幼粒细胞白血病HL-60细胞生长,同时伴随细胞的酸性磷酸酶活性也升高,形态上向成熟细胞方向改变,说明ANO确实能够诱导HL-60细胞分化。结合细胞形态和酸性磷酸酶活性的变化,提示细胞向单核-巨噬细胞系列分化。
维甲酸类化合物的作用机制是与细胞内的相应受体结合,通过影响基因转录而产生作用。与维甲类化合物相结合的受体属甾体/甲状腺激素受体超家属成员。ANO属于甾体类药物,其作用机制可能类似于维甲酸,即通过作用甾体受体而发挥其分化诱导作用。本实验结果ANO处理引起ER上调和HL-60细胞分化。而二者可被ER拮抗剂雌二醇所阻断,说明ER在ANO诱导HL-60细胞分化中起重要作用。至于ANO上调ER,可能是细胞在受体拮抗剂作用后,代偿性上调的结果,就象ER激动剂雌二醇下调ER一样[8]。
细胞在分化以前往往表现为生长阻滞,分裂能力下降,因此,分化诱导剂大多能抑制细胞生长。在分子水平即表现为与DNA复制及增生密切相关的基因表达减少,如PCNA、c-myc,c-myb等[9~11]。ANO处理确实能够抑制PCNA表达。PCNA是参与DNA复制和修复的重要成分,是DNA聚合酶δ的辅助因子。PCNA表达减少,将使细胞增生停止,DNA修复能力下降。ANO导致细胞生长抑制,细胞周期阻滞(G1细胞比例升高),可能与此药下调PCNA有关。有趣的是,本文并未观察到ANO在诱导HL-60细胞分化时,抑制c-myc的表达。这可能是所用方法不同所致。
以上结果表明ANO(2~8μmol/L)能够抑制肿瘤细胞生长,诱导HL-60细胞向单核-巨噬细胞系列分化,其作用可能是通过ER介导,抑制PCNA表达,阻滞细胞周期进展所致。
作者单位:楼丽君 衢州市人民医院(浙江省衢州市324000)
胥 彬 中国科学院上海药物研究所
参考文献
1 韩锐.肿瘤化学预防和药物治疗.北京:北京医科大学协和医科大学联合出版社,1993:219~40
2 Verstuyf A, Mathieu C,Verlinden L,et al. Defferentiation induction of human leukemia cells (HL60)by a combination of 1,25- dihydroxyvitamin D3 and retinoic acid (all trans or 9- cis). J Steroid Biochem Mol Biol,1995;53:431~ 41
3 Lou LG,Xu B. Induction of apoptosis in human leukemia cells by α - anordrin. Chin J Cancer Res,1997;9:1~ 5
4 Lou LG,Xu B.α - anordrin- induced apoptosis of leukemia K562 cells is not prevented by cycloheximide. Acta Pharmacol Sin,1997;18(2):169~ 72
5 胥彬,周佩琴,俞伟娟.双炔失碳酯的抗实验肿瘤作用研究.肿瘤,1989;9(5):197~9
6 刘淑卿,朱大元,高清勇,等.双炔失碳酯差向异构体的分离和定量分析.生殖与避孕,1987;7(3):36~8
7 Gong J,Li X,Darzynkiewicz Z. Different patterns of apoptosis of HL- 60 cells induced by cycloheximide and camptothecin. J Cell Physiol,1993;157:263~ 70
8 Gierthy JF,Spink BC,Figge HL,et al. Effects of 2,3,7,8- tetra- chlorodibenzo- ρ - dioxin,12- O- tetradecanoylphorbol- 13- acetate and 17β - estradiol on estrogen receptor regulation in MCF- 7 human breast cancer cells. J Cell Biochem,1996;60:173~ 84
9 Borden EC,Lotan R,Levens D,et al. Differentiation therapy of cancer:laboratory and clinical investigations. Cancer Res,1993;53:4109~ 15
10 Filmus J,Buick RN. Relationship of c- myc expression to differentiation and proliferation of HL- 60 cells. Cancer Res,1985;45:822~ 5
11 Sendler A,Kaffenberger W,Nuyken I,et al. Proliferation kinetics and PCNA expression of HL- 60 cells following ionizing irradiation and granulocytic differentiation. Cell Prolif,1993;26:531~ 43