第四节 脂代谢有关酶类与特殊蛋白质
参与脂质代谢的酶有LPL,HTGL,LCAT,ACAT,HMG-CoA还原酶,HMGCoA合成酶。脂质代谢过程中还有几种特殊蛋白质如CETP等。
一、脂蛋白脂肪酶
脂蛋白脂肪酶(lipoprteinlipase,LPL)是脂肪细胞、心肌细胞、骨骼肌细胞、乳腺细胞以及巨噬细胞等实质细胞合成和分泌的一种糖蛋白,分子量为60ku,含3%-8%碳水化合物。活性LPL以同源二聚体形式存在,通过静电引力与毛细血管内皮细胞表面的多聚糖结合,肝素可以促进此结合形式的LPL释放入血,并可提高其活性。LPL生理功能是催化CM和VLDL核心的TG分解为脂肪酸和单酸甘油酯,以供组织氧化供能和贮存。LPL还参与VLDL和HDL之间的载脂蛋白和磷脂的转换,ApoCⅡ为LPL必备的辅因子,其中的C端第61-79位氨基酸具有激活LPL的作用。在哺乳类动物如牛、鼠和猪等LPL的酶蛋白质一级结构有87%-94%的同源性,事实表明,LPL在进化过程中具有高度保守性,人类LPL、肝脂酶(hepatictriglyceridelipase,HTGL)及胰脂酶具有高度相似的氨基酸序列,推测三者可能起源于同一个基因家族,有共同的作用机制。
LPL基因位于第8染色体短臂8p22,长约35kb,由10个外显子和9个内含子组成,编码475个氨基酸残基的蛋白质,LPL基因位点存在多态性,主要分布在LPL基因内含子和侧翼序列中,其中内含子6中PVUⅡ多态位点和内含子8中HindⅢ多态位点与高脂血症有关,并为高脂血症的家系连锁分析提供了遗传标记。
LPL在实质细胞的粗面内质网合成,新合成的LPL留在核周围内质网,属于无活性酶,由mRNA翻译合成的无活性LPL,称为酶前体,再经糖基化后,才转化成活性LPL。从细胞中如何分泌,目前认为有两种机制,其一是细胞合成LPL后直接分泌,不贮存于细胞内,即称为基本型分泌;其二是调节型分泌,某些细胞新合成的LPL贮存在分泌管内,一旦细胞受到一个合适的促分泌刺激,LPL即分泌,此时分泌往往大于合成。所有细胞都具有基本型分泌,只有少部分细胞兼有两种分泌形式。存在于细胞膜外表面的硫酸肝素糖蛋白(heparinsulphateproteoglycans,HSPG)使酶保持一种无活力的浓缩状态,然后通过一个尚未阐明的机制由肝素促使分泌,即肝素后刺激血浆中得到活化的LPL,分布在含甘油三酯的脂蛋白中,主要是分解CM和VLDL的甘油三酯,并结合和附着在这些脂蛋白残粒中,可能作为肝摄取这些颗粒的信号。
LPL生理功能,目前认为是分解脂蛋白核成分的甘油三酯,也分解磷脂如卵磷脂、磷脂酰乙醇胺,并促使脂蛋白之间转移胆固醇、磷脂及载脂蛋白,其代谢产物游离脂肪酸为组织提供能量,或再酯化为TG,储存在脂肪组织中。另外,LPL还具有增加CM残粒结合到LPL受体上的能力,促进CM残粒摄取。
测定血浆LPL活性时,一定要静脉注射肝素,因为LPL对肝素亲和性很高。静脉注射肝素,使LPL从内皮细胞表面释放入血,这是测定血中LPL活性的一种必备操作。通常按每公斤体重10单位的量静脉注射,10分钟后采静脉血得到血浆再测LPL活性。一般静脉注射肝素后血浆总脂酶活性的1/3为LPL,剩余的几乎都是肝脂酶(HTGL)。目前还可用高浓度盐酸或鱼精蛋白选择性抑制LPL活性的方法测定其活性。最近报道,还可用LPL或HTGT抗体进行活性检测。
二、肝脂酶
肝脂酶(hepaticlipase或hepatiltriglyceridase或hepaticendothelaillipase,HL或HTGL)属于与血液循环中内源性TG代谢有关的酶之一,与LPL在功能上有相似之处,然而却是两种不同性质的酶。其特点是:①HL活性不需要ApoCⅡ作为激活剂;②SDS可抑制HL活性,而不受高盐浓度及鱼精蛋白的抑制;③主要作用于小颗粒脂蛋白,如VLDL、残粒残余CM及HDL,同时又调节胆固醇从周围组织转运到肝,使肝内的VLDL转化为LDL。经人及鼠cDNA克隆的DNA序列表明,HL是共有2个N连接多聚糖链的糖蛋白,含有499个氨基酸残基,分子量53ku,基因位于第15号染色体上。与分解代谢有关的丝氨酸位于145位。LPL和HL的基因同属一组基因族,在进化上较为保守。
HL在肝实质细胞中合成,在合成过程中,酶蛋白的糖化及紧随着的低聚糖化修饰过程是分泌HL的必要条件。免疫电镜研究表明,HL位于肝窦状隙内皮细胞表面,在肝素化后,HL可释放到血浆。激素可调节HL的释放,主要是类固醇激素,如雄性激素可升高HL酶活性,而雌性激素则相反。录怀孕或泌乳时,肝素化后血浆中HL活力与血浆的游离胆固醇或类固醇也呈负相关,肾上腺素抑制HL酶活性。另外胰岛素和甲状腺素在控制HL活力中有作用。
HL主要作用于VLDL、β-VLDL及VLDL残粒中的TG。HDL中积累的未酯化胆固醇在HL作用下由肝摄取,在HDL3转化为HDL2的过程中可防止肝外组织过量胆固醇的积累,其中HL起重要作用。
三、卵磷脂胆固醇脂酰转移酶
卵磷脂胆固醇脂酰转移酶(lecithin-cholesterolacyltransferase,LCAT)由肝合成释放入血液,以游离或与脂蛋白结合的形式存在,是一种在血浆中起催化作用的酶,其作用是将HDL的卵磷脂的C2位不饱和脂肪酸转移给游离胆固醇,生成溶血卵磷脂和胆固醇酯。血浆胆固醇几乎70%-80%是胆固醇酯,均是LCAT催化生成所致。LCAT常与HDL结合在一起,在HDL颗粒表面活性很高并起催化作用,对VLDL和LDL的颗粒几乎不起作用。LCAT在磷脂代谢中有重要的作用。
LCAT由416个氨基酸残基组成,分子量为6.3ku。属于糖蛋白,糖链约占24%,是维持其活性必不可少的组分,富含Glu、Asp、Gly、Pro、Leu。每一酶分子含4个Cys,其中两个连成二硫键。根据与胰脂酶序列的同源性比较,推测六肽Ⅰ178-G-H-S-L-G183可能是酶的活性中心。酶蛋白的α螺旋、β-折叠和其他结构比例分别为21%、24%和55%。LCATmRNA约为1400bp组成,其信号肽是440个氨基酸组成的密码子。
LCAT选择性底物是HDL,特别是新生盘状或小球形HDL3。HDL核心是LCAT酶反应产物胆固醇酯的贮存库,并通过胆固醇酯转移蛋白将CE转移至其他脂蛋白和细胞膜,并与其交换。
LCAT除肝细胞合成外,在小肠、脾、胰、胎盘、肾上腺等组织细胞发现有LCAT的mRNA,推测也可合成LCAT。
四、HMGCoA还原酶
HMGCoA还原酶(HMGCoAreductase)是合成胆固醇的限速酶,存在于小胞体膜,催化合成甲基二羟戊酸(mevalonicacid),并生成体内多种代谢产物,称之为甲基二羟戊酸途径。细胞内胆固醇水平调节主要依赖于内因性胆固醇合成途径和LDL受体摄取细胞外胆固醇的外因途径两条。Goldstein和Brown阐明其抑制机制认为,细胞内Ch可作为HMGCoA还原酶抑制剂使其活性降低,肝细胞膜上的LDL受体增加,从血中摄取Ch也增加,使血中胆固醇水平降低。设想使HMGCoA还原酶活性降低的药物可使血在胆固醇水平下降,尤其是对FH的杂合子患者,凡能使LDL受体数锐减的药物均可起治疗作用。
以Merinolin的HMGCoA还原酶抑制剂投入,使狗血中LDL消失速度上升,LDL产生速度下降;肝移植的小儿FH纯合子患者,用梅维诺林治疗可使LDL胆固醇降低40%,而LDL产生速度下降35%。这种抑制剂的投入使LDL合成减少的机制,有两种可能,一是胆固醇合成减少使VLDL生成量降低;第二是HMGCoA还原酶抑制剂使VLDL残粒或β-VLDL异化增加,转变成LDL减少。体外抑制实验也证实,从VLDL残粒转变到LDL的速度比正常状态下小20倍,与此同时LDL受体的亲和力也增加。
五、胆固醇酯转移蛋白
血浆胆固醇酯转移蛋白(cholesterolestertransferprotein,CETP)又称为脂质转运蛋白(lipidtransferprotein,LTP),从血浆d>1.21g/ml组份中精制得到,CETP的非极性氨基酸残基高达45%,是一种疏水性蛋白质,很容易被氧化而失活。CETP由肝、小肠、肾上腺、脾、脂肪组织及巨噬细胞合成的476个氨基酸残基组成的多肽,细胞内成熟蛋白分子量为740ku。最近已阐明其基因结构,存在于第16染色体,与LCAT的基因靠近。
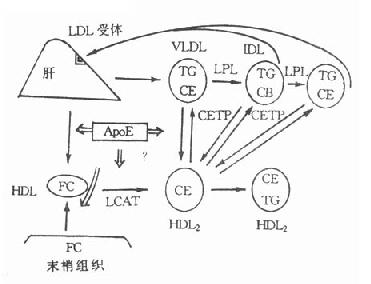
图4-9 胆固醇逆转运系统
CETP促进各脂蛋白之间脂质的交换和转运。CETP在完成和促进胆固醇逆转过程中充当着重要的角色。周围组织细胞膜的游离胆固醇与HDL结合后,被LCAT酯化成胆固醇酯,移入HDL核心,并可通过CETP转移给VLDL、LDL,再被肝的LDL及VLDL受体摄取入肝细胞,至此,完成了胆固醇从周围末梢组织细胞经HDL转运到肝细胞的过程,称之为胆固醇的逆转运(reversecholesteroltransport,RCT)如图4-9所示。
目前认为,血浆中各脂蛋白的胆固醇酯主要通过LCAT和CETP的共同作用生成。血浆中CE90%以上来自HDL,其中约70%的CE在CETP作用下由HDL转移至VLDL及LDL后被清除。CETP与LCAT一样也能与HDL结合在一起。
当血浆中CETP缺乏时,HDL中CE蓄积、TG降低,无法转运给VLDL及LDL,出现高HDL血症,而VLDL、LDL中的CE减少,TG增加。这是因为从HDL将CE转运到含ApoB脂蛋白上发生障碍所致。利用酶联免疫方法测血浆中CETP活性,此时其活性降低。