第二节 载脂蛋白纯品的鉴定
载脂蛋白分离纯化后,获得了所需要的纯品,该纯品纯度及其品种可通过下述方法进行鉴定。
一、免疫电泳法
免疫电泳法既可用于鉴定蛋白种类,又可鉴定其纯度。
制备1%的琼脂糖,以0.1mmol/L巴比妥缓冲液(0.05μ,pH8.6)为溶剂,制作一块约7×4cm的大小,厚度为0.2~0.3cm的琼脂糖凝胶,以玻璃板或薄膜为支持物,于凝胶正中打孔(直径0.2cm)。1孔加全血清5μl,2孔(中间孔)加纯化的某产品,3孔加已知某载脂蛋白。电泳电极液为0.05μ,pH8.6的巴比妥缓冲液。当标本前沿泳动到距离凝胶端1cm左右,停止电泳,取出凝胶板,在凝胶板三孔之间开两条宽0.2cm,长5~5.5cm长的凝胶槽。1与2孔之间的凝胶槽(A槽)中加入羊抗人全血清抗体,2与3孔之间的凝胶槽(B槽)加入羊抗人某Apo单价特异抗血清,将凝胶板置于含少量水的大平皿中,加盖,水平置于37℃培养箱24h,再观察弧形白色沉淀线,与A槽沉淀线位置比较若位置完全相同,初步可以确认为2孔纯化产品与3孔标准蛋白是同一蛋白质,如图17-7所示。
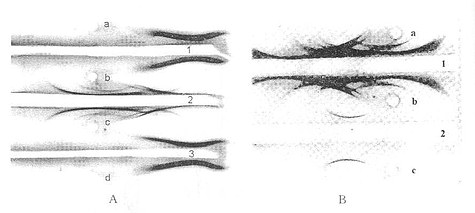
图17-7 免疫电泳图(琼脂糖凝胶)
A:1、2、3分别为抗人ApoAⅠ血清(第一化学)、抗人全血清,抗人ApoAⅠ血清(自制);a、b、c、d分别为ApoAⅠ纯品(纯化产品)、人血清、人血清、ApoAⅠ纯品(sigma)
B:1、2分别为抗人全血清,抗有ApoB血清(自制):a、b、c分别为人血清、人血清和人ApoB纯品(自制)
二、免疫火箭电泳
按本章节的方法进行操作,若为单一火箭沉淀峰,也可判纯化产品为单一蛋白,如图17-8所示。
三、免疫双扩散法
制备1%琼脂糖凝胶(0.05μ,pH8.6的巴比妥缓冲液为溶剂),按图打孔。图17-9中孔加入已知某Apo单价特异羊抗人血清,周边第1孔加纯化产品,第2孔加已知某Apo纯品,置37℃培养箱24h,若第1与2孔旁两条白色沉淀线相互融成一个弧形,无分叉,表明1孔与2孔的蛋白质与中孔抗血清的抗有相同的抗原性,可确认为同一蛋白质。

17-8 免疫火箭电泳图
A:琼脂糖凝胶板含抗人全血清、抗原孔含人ApoAⅠ纯品;
B:琼脂糖凝胶析含抗人全血清、抗原孔含人ApoB纯品。
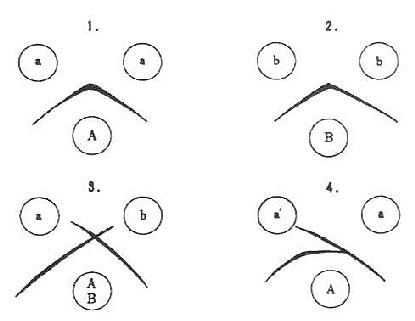
图17-9 各种抗原抗体系的沉降线示意图
1,2:同一抗原抗体系(complete identity)
3:不同的抗原抗体系(nonientity)
4:部分相同的抗原抗体系(partialidentity)
四、等电聚焦电泳
利用IEF-PAGE测等电点,根据等电点确认蛋白质性质。
五、蛋白质分子量测定
从化学观点考虑,分子量是组成蛋白质分子的各原子量总和。但是,对大分子的蛋白质来讲,若不知道分子量也无法得知每个分子的元素组成情况。为此,人们在蛋白质的研究中,对测定其分子量工作极为重视,先后用于测定蛋白质分子量的方法有渗透压、粘度、光散射、蛋白质氨基酸序列分析法、超速离心(沉降速度或沉降平衡)、凝胶层析和SDS-PAGE等法。载脂蛋白分子量测定多采用超速离心沉降速度法、凝胶层析法和SDS-PAGE法。
凝胶法层析用:1gM=A-B(Ve/Vo)
SDS-PAGE用:lgM=A-BRf
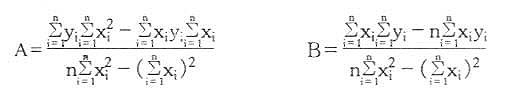
式中,对已知标准样品,x和y分别为实验值和已知值。n是实验的点数。采用上述两个方程,由已知样品的数据,可以求出标准线的两个常数A、B值。对未知样品,只要测出x,利用A、B值可以计算出y值。总之,从实验测得的数据计算该实验方法所用方程的常数,再用这个常数计算出未知样品的分子量,所得结果比作图法精确,且很方便。
下文仅介绍SDS-PAGE作图法测定蛋白质的分子量。
十二烷基磺酸钠(sodium dodecyl sulfate,SDS)是一种阴离子去污剂,于100℃加热,在β-巯基乙醇存在下,可以使大多数多聚体蛋白质的四级结构解体,并与各亚基牢固地结合,从而遮蔽了蛋白质分子上原有电荷,同时带上强的负电荷。
由于所有的SDS-蛋白质复合物(图17-10),在电泳时都以同样的电荷按分子量大小不同向正极移动,作SDS聚丙烯酰胺凝胶泳动(SDS-PAGE)时,其泳动速度仅决定于蛋白质的分子量。SDS与蛋白质的结合是成比例的,所以SDS-蛋白质复合物在泳动中的不同速率,就反映了分子量的不同。与分子量的对数和相对迁移率成一定比例关系。使用已知分子量的标准物作标准曲线(图17-11,图17-12)或用计算法确定标准曲线的常数,即可求出未知样品的分子量。用这种方法测定的分子量是亚单位肽链的分子量。
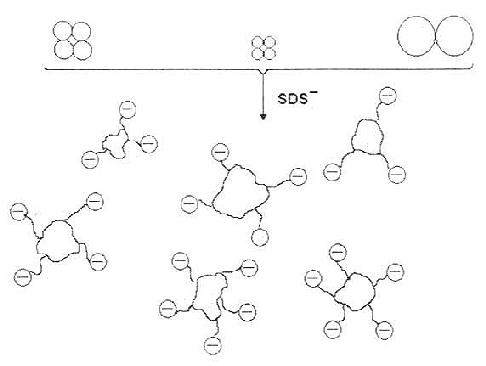
图17-10 SDS对蛋白质四级结构的破坏作用,SDS与亚基牢固地结合,遮蔽了蛋白分子的原有电荷
实验结果也可以通过公式运算求蛋白质分子量:
先求得迁移率Rf,Rf=de/do
de为样品迁移距离,do为前沿迁移距离(染料)
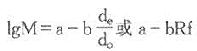
从几种标准样品的Rf值和分子量对数,用最小二乘法能准确地求得a、b二常数,从而可进行未知物分子量的计算。
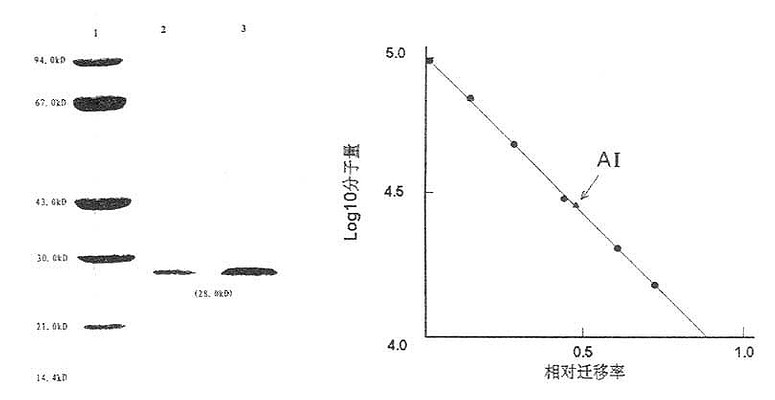
图17-11 人ApoAⅠ分子量测定图(SDS-PAGE)
图17-12标准蛋白质分子量测曲线(SDS-PAGE)
1为蛋白质标准分子量(LKB):
2为ApoAⅠ纯品(Sigma);
3为ApoAⅠ纯品(自制)
SDS-PAGE的分子量测定简要步骤是:①制备4%~30%的聚丙烯酰胺梯度凝胶;②待测蛋白纯品和标准分子量标本的制备,按蛋白样品1mg/ml浓度溶于含有20%蔗糖的电极缓冲液中,加入5μl0.1%溴酚兰作指示染料,取50μl上样;③电泳:电极缓冲液(有多种),含1%SDS;④染色脱色:考马斯亮兰R-250染色,脱色;⑤制作标准分子量曲线;量取从原点到前沿溴酚兰及原点至各条蛋白区域的距离。计算各自标准蛋白的Rf值,以LogMW对相应的Rf作图,绘成标准分子量蛋白曲线如图17-8、图17-9所示,以待测蛋白质的Rf值在标准曲线上得到LgMW值,计算待测Apo纯品的分子量。
测定分子量的SDS-PAGE法主要优点是快速,样品用量少,可同时测定几个样品。缺点是误差较大,误差主要与电泳蛋白区域移动距离测量是否有关。
SDS-PAGE法测定的是亚单位肽链的分子量。常用的标准蛋白质如表17-1所示。
表17-1 标准蛋白质及其分子量
| 名 称 | 分 子 量 | 名 称 | 分 子 量 |
| 细胞色素C | 11700 | 过氧化氢酶(单体) | 60000 |
| 核糖核酸酶 | 13700 | 牛血清白蛋白(单体) | 68000 |
| 肌红蛋白 | 17200 | 乳酸脱氢酶(单体) | 36000 |
| 胰凝乳蛋白酶原 | 25700 | 乳酸脱氢酶 | 130000 |
| 胰蛋白酶 | 23300 | β-淀粉酶 | 215000 |
| 羧肽酶A | 34600 | 过氧化氢酶 | 240000 |
| 胃蛋白酶 | 35000 | 黄嘌呤氧化酶 | 275000 |
| 卵清白蛋白 | 45000 | 脲酶 | 483000 |
六、双相电泳
血浆或组织中有成千累万种蛋白质,等电点近似,分子量大小类同的蛋白质很多,若仅单一测蛋白质的pI或分子量,还不足以说明是某一的蛋白质,可能是也可能不是。如果既测定pI,又测定分子量,利用这两种参数鉴定蛋白,其确认的准确率将得到很大的提高,因为这两种参数都相同的蛋白质的概率是很小的。为此常采用双相电泳技术即第一相为IEF-PAGE,另一相为SDS-PAEG,进行蛋白质的鉴定。
七、蛋白质化学组成分析
末端氨基的分析,是鉴定蛋白质纯度的方法之一。一条肽链的蛋白质,通过N-末端的定量分析,每克分子蛋白质应当有整数克分子的N-末端氨基酸,少量其他末端氨基酸的存在,常常表示存在有杂质。
分析蛋白质各种氨基酸百分比,也可作为蛋白质各类鉴定的参考值。
最终的纯度标准,应当是氨基酸顺序的测定。
-
《动脉粥样硬化》 中的相关章节:
……
第三节 血浆脂蛋白电泳分离定量法
第四节 血清脂蛋白非电泳定量法
(血浆脂蛋白的分离纯化及定量)参考文献
第十七章 血清载脂蛋白分离纯化及其鉴定
第一节 载脂蛋白分离纯化
第二节 载脂蛋白纯品的鉴定(当前页)
第三节 蛋白质浓度的测定
(血清载脂蛋白分离纯化及其鉴定)参考文献
第十八章 血清载脂蛋白的免疫测定
第一节 血清载脂蛋白定量的方法学及其参考值的评价
……