第二节 FCM在生物医学工程学方面的应用
流式细胞术在细胞生物学、分子遗传学、微生物学、免疫学、分子生物学以及临床肿瘤学、临床血液学等诸多领域都有广泛应用。本节 概要介绍它们的技术途径及主要原理,大家可以从中看出它们是和细胞化学密切相关的。
一、FCM应用的技术途径
FCM是通过测量细胞的多种参量来获取信息的。细胞参数分为结构参量和功能参量两大类。结构参量主要用于描述细胞的化学组分和形态特征;功能参量主要是描述细胞整体的理化和生物特性。这些参量有的需要经荧光标记方可测定,有的并不需要荧光标记。DNA以及RNA的含量,蛋白总含量、胞内pH值和细胞大小等为结构参数;细胞周期动力学、特殊配体的鉴定、特殊细胞的生物活性等则为功能参数。
1.DNA和RNA的测量和分析DNA和RNA的含量可以用多种荧光探针标记后测出。对细胞内DNA含量的测定可用于细胞生物学方面的研究和临床肿瘤学的诊断;测量RNA的含量可用于血液中的网织红细胞的检测和计数;DNA和RNA含量的测定可以用于区别细胞周期中的G0和G1期。常用的荧光探针有吖啶橙(AO,Acridine·orange)、派洛宁Y(PY,Pyronine Y)、HO(Hoechst)系列和色霉素A3(CA3)等。利用HO/CA3双染色还可分析DNA的碱基组成。还可以结合Brdu (Bromodeoxyuridine, 溴脱氧尿嘧啶核苷)单克隆抗体免疫荧光来测定细胞内DNA合成。
2.蛋白质总量测定用FCM可以测定细胞中蛋白的总含量,以检测一个细胞群体生长和代谢的状态,或区别具有不同蛋白含量的细胞亚群,如血液中的白细胞的分类。检测总蛋白的常用荧光探针为异硫氰基荧光素(FITC,Fluorescein isothiocyanate),FITC以共价键方式与蛋白上带正电的残基结合。
3.特殊配体的测定配体是与不同的细胞结构特异结合很强的各种大分子和小分子,通过对特异性的荧光标记的配体的测定可以获得不少有关结构参量和功能参量的信息。例如用标记的外源凝集素可检测细胞表面糖;用标记抗体可测表面抗原;用标记多聚阳离子可检测细胞表面电荷;用标记的激素、生长因子、神经递质和病毒等可检测细胞受体;用标记的大分子、微生物等可检测细胞的内吞性;用荧光素标记的亲和素以及带有DUTP的生物素衍生物的DNA探针跟靶细胞的DNA杂交能够检测原位的特殊基因等。这方面的应用范围广、有前途,已经成为研究细胞和组织中的抗原、基因和各种生化过程的强有力的新技术。用于这方面工作的荧光探针主要有FITC、若丹明系列(如四甲基异硫氰基若丹明TRITC、异硫氰基若丹明X-RITc 和美国德州红等)、藻胆蛋白系列等。由于各种荧光探针具有不同的光谱特性,在使用中要注意正确地使用激光光源和滤片。
4.生物活性的测定就生物流行性来说,主要包括两方面工作:①细胞本身的死活;②活细胞生物功能发挥的强弱。前项工作单一,后项工作要复杂得多。FCM用来判断细胞死活的常用荧光探针有二大类:一类是能透过活的细胞膜进入细胞内而发出荧光的物质;例如下醋酸酯荧光素(FDA,flourescein Diacetate)它可被活细胞持留而发出黄绿色荧光;若细胞有损伤则会从细胞中流失,观察不到荧光。另一类是不能透过活细胞膜,但能对固定的细胞及膜有破损的细胞的核进行染色,例如碘化丙啶(PI,Propidium iodide)和溴化乙锭(EB,Ethidiumbromide )就是常用的第二类荧光探针。
用FCM来测定活细胞生物功能发挥方面和性能的指标很多。例如可用来测细胞膜电位、细胞内pH值和细胞内钙等,这些都和细胞的激活密切相关。FCM也可用来测膜结构的流动性或微粘度等。有报告可以用FCM代替51Cr的放射免疫分析来测定天然杀伤细胞(NK, Natu-ral killer cells)对靶细胞毒理学活性的大小。
二、FCM的典型应用简介
下面简单介绍FCM在各个领域中应用的典型实例,以求对FCM应用的全面了解,并能深入了解FCM在免疫细胞化学中应用的背景。
1.在细胞生物学方面的应用细胞生物学是FCM应用最广泛也是最基本的领域,细胞周期分析是其基本分析内容之一,而实施的技术途径是通过测定细胞周期各时相的DNA含量来达到的。
众所周知,细胞周期由G1期、S期、G2期和M期所构成的。各期细胞的DNA含量如下:G1期为2C,G2期和M期为4C,S期则在2C到4C之间。所以在FCM的DNA直方图上形成的谱线则为峰分布,而且G1峰的道数恰好是G2和M峰道数的一半(图10-7)。研究表明:对于正常细胞群,各周期时相的细胞数的比例是同一的;对于恶性病变的细胞群则是非均一的(图10-8)。

图10-7 细胞周期的DNA直方图
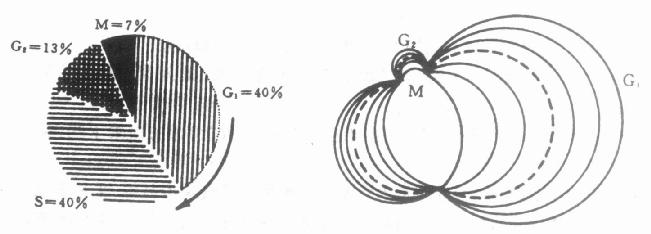
图10-8 细胞周期中的细胞数目与肿瘤的关系
临床肿瘤病学已经注意到细胞动力学的重要性。研究工作表明:肿瘤细胞对化疗和放疗的敏感程度与细胞的增生率高低密切相关;采取细胞同步化(Cell Synchronization)措施可以提高疗效。例如可以使用雌激素这种外源性药物让雌激素受体阳性的乳腺癌细胞同步化。
临床微生物学可以用FCM对大量细菌的DNA和RNA含量进行测量,进行微生物鉴定、医学常规中的细菌抗生素敏感试验和传染活性的测定。
FCM优良的分析和分选功能在分子遗传学领域也能充分发挥。例如流式细胞核型分析技术就是用FCM对染色体进行分类、纯化,检测或定量测量细胞表面或内部由特异基本所编码的成份。这方面的成果已用在畜类性别的预选择,以及对人类计划生育等方面的工作。
2.在免疫学方面的应用 FCM以它的快速、灵活及定量的特点被广泛地应用于免疫学的基础研究和临床应用的各个方面,尤其是结合单克隆抗体技术,在免疫分型、分选、肿瘤细胞的免疫监测、机体免疫状态的监测、免疫细胞的系统发生及特性研究等方面更能起到重要作用,成为现代免疫技术的重要组成部分。基于免疫技术是免疫细胞化学分析技术的基础,我们着重介绍FCM在免疫应用中的技术问题。
(1)免疫应用的激发光源和滤片系统:适用于免疫技术的FCM的激发光是氪离子气体激光器,光谱中波长为531nm和856nm的谱线最强。为了扩大仪器对双标记或三标记染色的荧光信号的分辨范围可使用双激光光源。
为了减少细胞由于激光束造成的散射光对光电倍增管的影响,要使用贴有干涉膜的滤片系统。为了同时测定两种波长以上的荧光信号,光路中还要使用二向性分光元件。
为了测定伴随细胞转化过程所产生的早期免疫及生化性质的改变,例如膜的流行性,DNA构象变化等,可以使用偏振片。
总之,应用于免疫学时要充分考虑有关光源及光学滤片系统的正确使用。
(2)免疫应用的荧光染料及染色:免疫应用中的荧光染料主要有FITC(488nm)、TRITC(515nm)、PE(藻红蛋白,575nm)及其组合。在进行多种标记时特别要注意结合抗体的每种色素都不干扰抗体反应的特异性,也不相互干扰。
免疫荧光染色有直接法和间接法二类:
①直接染色法
1)取约106的细胞置于尖底离心管内,管内液体要少些。加荧光标记抗体,在4℃温度下静置15~30min。若作双标记染色也可直接加入。
2)用冷的10%的小牛血清、0.1%的叠氮钠溶液,1/15mol/L的PBS(pH4.4)离心清洗细胞2次。1000rpm离心5min或4000rpm离心1min。
3)加入适量缓冲液待测。
②间接染色法:
1)取106细胞加特异的第一抗体,4℃温度下静置15~30min。
2)加缓冲液离心清洗2次后,吸尽残留液体,弹散沉淀,加入荧光标记的第二抗体,4℃静置30 min。
3)缓冲液离心清洗2次后加入适量缓冲液待测。为减少无关因素干扰,操作尽量在水浴中进行。
染色中应注意的事项:①细胞标本在整个过程中要尽量保持新鲜,采用有效措施防止表面抗原消失和细胞死亡;②荧光标记物用前应用滤膜或高速离心去除颗粒或沉渣以减少非特异性干扰;③细胞标本染色前应除死细胞;④为提高灵敏度可用三步间接染色法。
(3)免疫荧光标本的特殊处理:
①死细胞及碎片去除:样品中不可避免地存在着死细胞及碎片,影响分析结果。对于血细胞可用FCM通过0。散射的差异不经染色而将死细胞分出弃除;对于培养细胞,由于其大小分布不均,可在样品内加少量PI染色后将死细胞去掉。一般情况下即可用仪器直接去除碎片,也可用血清沉降法去除大碎片,用离法去除小碎片。
②标本的保存和固定:实验中大多数样品在染色或分析前需要保存一定的时间,有时甚至需要进行固定。
未染色的新鲜标本贮存方法如下:10%二甲基亚砜,90%小牛血清,5×106~1×107细胞在-70℃过夜,然后置液氮中可长期保存。
免疫染色未经固定的标本在4℃可保存48h。若需存放时间较长、或标本具有传染性,应该用固定剂固定。常用的固定剂配方是:1%~4%的多聚甲醛和PBS或0.8%的生理盐水配成p H7.2的固定液;或用0.37%~1.5%甲醛和PBS配成p H7.4的固定液。固定方法是:将经免疫荧光染色的细胞离心沉淀,再加入固定液混匀,放在4℃温度保存。一般来说,经固定处理的标本保存1周至2个月,多数样品的阳性细胞群体比例及荧光强度增色能保持在正常范围之内。
(4)主要检测的免疫指标:
①细胞毒试验:细胞毒是机体的一种免疫监督机制,细胞毒实验是一项重要的免疫指标。例如天然杀伤细胞NK(Natural killer)是一种引起免疫媒介的效应物,在抗肿瘤及感染因子的免疫监督系统中起着重要作用。研究表明,对NK细胞的测量可以做为免疫治疗监测的重要参数和有效的预后征状的指标。所使用的荧光探针为CFDA(Caboxy-fluorescein diacetate)。
②吞噬功能实验:单核吞噬细胞系统是机体的主要防御系统之一。FCM可以快速、定量地检查吞噬细胞的吞噬能力和速度。
③I型变变态反应的IgE受体细胞、IgE结合因子的检查。
④胞浆Ig及血清Ig分析,血小板表面的IgG测定,等等。
3.在临床方面的应用FCM在临床诊断、疗效评价和预后预测等方面都发挥了一定的作用。工作做得较多的主要在肿瘤学、血液病学等。这些都和FCM在荧光细胞化学中的直接应用有关。
(1)癌前病变的检测和预后评价:有效地发现癌前病变而给予阻断治疗,无疑是肿瘤防治的重要环节 。FCM的探测对象主要是癌前细胞,即那些处于正常细胞向癌细胞转化的量变阶段、尚未达到质变的细胞。研究表明,除心肌、肝组织及精子细胞外,人类正常的体细胞都具有恒定的DNA二倍体含量,而那些癌前细胞和癌细胞则在其发生发展过程中伴有DNA含量变化异常。另在资料表明:癌前病变向癌变的转化发生率与细胞的不典型增生程度有关,而细胞的不典型增生程度又与DNA含量的异常改变呈平行关系。利用FCM可以定量地测出癌前细胞的DNA含量并根据DNA分布直方图直观地反映出细胞的周期分布状态,从而了解到癌前细胞增殖能力变化的动态过程,这样便可以获得一些从组织形态学中难以得到的信息。
表10-1 是以胃粘膜为例比较正常细胞和胃癌细胞在DNA含量及细胞周期分布方面的差异。
表10-1 正常与胃癌的胃粘膜细胞DNA含量方面的差异
| 二倍体 | DNA含量(%) | 细胞周期分布(x±s) | |||
| 非整倍体 | G0/G1 | S期 | G2/M期 | ||
| 正常细胞 | 100 | 0 | 88.9±1.2 | 5.0±0.6 | 3.4±0.7 |
| 胃癌患者细胞 | 0 | 100 | 77.3±1.8 | 10.9±1.1 | 7.4±0.7 |
从表中看出差异是显著的。我国一些学者也提出有关FCM诊断癌肿细胞的细胞标准,并已付之临床应用。
目前,对于癌症病人预后评估的主要依据是病理组织学分级和临床分期等指标,不少人已认识到用FCM来检测DNA是对肿瘤预后评价的一个较为客观有效的指标。总的倾向是:异倍体的出现是恶性肿瘤的一个标志;异倍体肿瘤的恶性程度高、复发率高、转移率高及死亡率高;二倍体及近二倍体肿瘤预后较好。
在临床血液学方面的应用目前也以血液系统的肿瘤诊断、分型和预后关系等方面的应用为主;其主要技术途径也是基于对DNA倍体分析和细胞增殖周期的分析。限于篇幅不再多叙。有关的技术细节 将在下节 以FCM在外周血白细胞的免疫组织化学分析方面的应用为例详加介绍。
(2)DNA指数:由于DNA的非整倍体细胞是肿瘤的特异性标志已经得到肿瘤学界的公认,在些学者提出建议采用流式细胞术DNA分级指数(Flow cytometry DNA Crading Index, 简称DNA指数或DI)表示DNA含量的异常程度。根据1984年国际分析细胞学会名词审定委员会的规定:
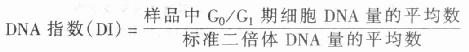
一般样品应采用同种或同个体的正常细胞为标准二倍体细胞。在血液学研究中通常以正常人外周血淋巴细胞作为标准二倍体细胞。需要指出的是,在报告DNA的测定结果时必需包括G0/G1峰的变异和系数,即C.V值,若有多个DNA干系则要给出各个G0/G1峰的C.V值。用于肿瘤临床诊断的总体依据是:a.正常二倍体的DI=1.0,判断为阴性;b.出现二个或多个可以分辨的G0/G1峰则可判断为阳性;c.虽无明显的G0/G1峰的分化现象,但峰的C.V值较大,则可根据DI数个及其它有鉴别意义的征状给出参考性的诊断。
以上我们主要从FCM在生物医学工程学领域应用的基本原理和技术途径介绍了和组织化学有关的内容,至于一些技术细节 则在下节 做较为详细的说明。
-
《实用免疫细胞与核酸》 中的相关章节:
……
第五节 放射免疫分析法的建立
参考文献
第九章 免疫细胞化学与图像分析
第十章 流式细胞术(FCM)在免疫细胞化学中的应用
第一节 流式细胞术简介
第二节 FCM在生物医学工程学方面的应用(当前页)
第三节 FCM对外周白细胞的免疫荧光分析
参考文献
第十一章 免疫细胞化学在神经科学中的应用
参考文献
……