第三节 分子杂交
一、概述
前面已经介绍了核酸分子单链之间有互补的碱基顺序,通过碱基对之间非共价键(主要是氢键)的形成即出现稳定的双链区,这是核酸分子杂交的基础。杂交分子的形成并不要求两条单链的碱基顺序完全互补,所以不同来源的核酸单链只要彼此之间有一定程度的互补顺序(即某种程度的同源性)就可以形成杂交双链。分子杂交可在DNA与DNA、RNA与RNA或RNA与DNA的二条单链之间进行。由于DNA一般都以双链形式存在,因此在进行分子杂交时,应先将双链DNA分子解聚成为单链,这一过程称为变性,一般通过加热或提高pH值来实现。使单链聚合双链的过程称为退火或复性。用分子杂交进行定性或定量分析的最有效方法是将一种核酸单链用同位素或非同位素标记成为探针,再与另一种核酸单链进行分子杂交。
核酸杂交技术基本上是Hall等1961年的工作开始的,探针与靶序列在溶液中杂交,通过平衡密度梯度离心分离杂交体。该法很慢、费力且不精确,但它开拓了核酸杂交技术的研究。Bolton等1962年设计了第一种简单的固相杂交方法,称为DNA-琼脂技术。变性DNA固定在琼脂中,DNA不能复性,但能与其它互补核酸序列杂交。典型的反应是用放射性标记的短DAN或RNA分子与胶中DNA杂交过夜,然后将胶置于柱中进行漂洗,去除游离探针,在高温、低盐条件下将结合的探针洗脱,洗脱液的放射性与结合的探针量呈正比。该法尤其适用于过量探针的饱和杂交实验。60年代末,Britten等设计了另一种分析细胞基因组的方法。该法是研究液相中DNA的复性以比较不同来源核酸的复杂度,典型的方法是:从不同生物体(细菌、酵母、鱼和哺乳动物等)内分离DNA,用水压器剪切成长约450核苷酸(nt)的片段。剪切的DNA液(含0.12mol/L磷酸盐缓冲液或0.18mol/l Na+),经煮沸使dsDNA热变性成ssDNA。然后冷至约60℃,在此温度孵育过程中,测定溶液一定时间内的UV260nm的吸光度(减色效应)来监测互补链的复性程度。通常该实验可比较不同来源生物DNA的复性速率,并可建立序列复杂度与动力学复杂度间的关系。
60年代中期Nygaard 等的研究为应用标记DNA或RNA探针检测固定在硝酸纤维素(NC)膜上的DNA序列奠定了基础。如Brown等应用这一技术评估了爪蟾rRNA基因的拷贝数。RNA在代谢过程中被3H尿嘧啶标记,并在过量的情况下与膜上固定的基因组DNA杂交,继而用RNase处理,消化非特异性结合的RNA。漂洗后计数以测定杂交探针的量。通过计算与已知量DNA杂交的RNA量即可评估rRNA基因数。由于当时缺乏特异探针,这种方法不能用于研究其它特异基因的表达,这些早期过量探针膜杂交试验实际上是现代膜杂交实验的基础。
进入70年代早期,许多重要的发展促进了核酸杂交技术的进展。例如,对特异基因转录产物的分析和对动力学杂交实验又有兴趣。固相化的Poly U –Sepharose和寡(dT)-纤维素使人们能从总RNA中分离PolyA+ RNA。用mRNA的经纯化技术可从网织红细胞总RNA中制备α-和β-珠蛋白mRNA混合物。这些珠蛋白mRNA首次被用于合成特异的探针以分析珠蛋白基因的表达。由于制备cDNA探针很繁琐,所获得cDNA的长度和纯度也不稳定。所以寻求新的探针来源是使分子杂交技术进一步推广的基础。
70年代末期到80年代早期,分子生物学技术有了突破性进展,限制性内切酶的发展和应用使分子克隆成为可能。各种载体系统的诞生,尤其是质粒和噬菌体DAN载体的构建,使特异性DNA探针的来源变得十分丰富。人们可以从基因组DNA文库和cDNA文库中获得特定基因克隆,只需培养细菌,便可提取大量的探针DNA。迄今为止,已克隆和定性了许多特异DNA探针。
由于固相化学技术和核酸自动合成仪的诞生,现在可常规制备18~100个碱基的寡核苷酸探针。应用限制酶和Southern印迹技术,用数微克DNA就可分析特异基因。特异DNA或RNA序列的量和大小均可用Southern印迹和Northern印迹来测定,与以前的技术相比,大大提高了杂交水平和可信度。
尽管取得了上述重大进展,但分子杂交技术在临床实用中仍存在不少问题,必须提高检测单拷贝基因的敏感性,用非放射性物质代替放射性同位素标记探针以及简化实验操作和缩短杂交时间,这样,就需要在以下三方面着手研究:第一,完善非放射性标记探针;第二,靶序列和探针的扩增以及信号的放大;第三,发展简单的杂交方式,只有这样,才能使DNA探针实验做到简便、快速、低廉和安全。
二、探针-靶反应
从化学和生物学意义上理解,探针是一种分子,它带有供反应后检测的合适标记物,并仅与特异靶分子反应。抗原-抗体、外源凝集素-碳水化合物、亲和素-生物素、受体-配基(ligand)以及互补核酸间的杂交均属于探针-靶分子反应。蛋白质探针(如抗体)与特异靶分子是通过混合力(疏水、离子和氢键)的作用在少数特异位点上的结合,而核酸探针与互补链的反应则是根据杂交体的长短不同,通过氢键在几十、几百甚至上千个位点上的结合。因为有机溶液可降低杂交体的稳定性,所以,疏水反应对互补核酸链的结合也有一定的作用,但对其特异性影响甚微。
核苷酸经某一原子、功能基团或长侧链修饰后仍可能进行碱基配对,这取决于修饰的部位和修饰的性质。这一特性有助于理解非放射性核酸探针标记物的设计和125I与DNA探针的化学结合。能与核酸结合的单一原子有银、溴和碘等,这些元素可与嘧啶(胸腺嘧啶除外)环的C-5位或嘌呤环的C-8位反应而不影响氢键的形成。溴亦可与胸腺嘧啶的C-6位结合。而胞嘧啶的C-4和腺嘌呤的N-6就不能被修饰,否则会影响碱基配对,尽管C的N-4位和A的N-6位参与了氢键形成,但它们也是标记位点。这是因为标记的探针每1kb只掺入10~30个修饰碱基,即仅4%~12%的单个碱基被修饰的类似物取代了。尽管掺入位点处的碱基配对较弱或不存在,但对整个杂交分子的稳定性影响很小。防止氢键破坏的一种方法就是修饰探针,即探针克隆入M13载体中,只修饰载体区而不修饰插入片段。当用放射性同位素32P和35S标记核酸时,由于同位素是掺入核酸骨架的磷酸二脂键中,因此碱基未发生任何修饰。在5’端的磷酸基团上可进行化学修饰,这是标记寡核苷酸探针的有效方法。因为这种方法是在一个探针分子上标记一个检测的基团,所以,对长的克隆探针不适用。
此外,还可利用修饰的碱基来增加杂交的稳定性和特异性。2-氢基腺嘌呤可替代寡核苷酸探针中的腺嘌呤通过形成3个氢键以增加杂交体的稳定性。另外,在G-C丰富的RNA探针中,可用次黄嘌呤代替鸟嘌呤以获得特异的杂交。因为次黄嘌呤和鸟嘌呤间只形成2个氢键,有效地降低了杂交体的Tm值,这样,Tm值与杂交温度更接近,杂交的严格性就增加了,因此,也就增加了特异性。
很显然,结合位点的不同和可检测基团与检测系统的不同,可派生出很多核酸探针标记方法。这是由核酸的化学结构和性质所决定的。只有在对核酸分子的探针-靶反应的化学本质有了深入了解之后,才能更好地理解后面的章 节 内容。
三、核酸探针的种类
基因探针根据标记方法不同可粗分为放射性探针和非放射性探针两大类,根据探针的核酸性质不同又可分为DNA探针,RNA探针,cDNA探针,cRNA探针及寡核苷酸探针等几类,DNA探针还有单链和双链之分。下面分别介绍这几种探针。
(一)DNA探针
DNA探针是最常用的核酸探针,指长度在几百碱基对以上的双链DNA或单链DNA探针。现已获得DNA探针数量很多,有细菌、病毒、原虫、真菌、动物和人类细胞DNA探针。这类探针多为某一基因的全部或部分序列,或某一非编码序列。这些DNA片段须是特异的,如细菌的毒力因子基因探针和人类Alu探针。这些DNA探针的获得有赖于分子克隆技术的发展和应用。以细菌为例,目前分子杂交技术用于细菌的分类和菌种鉴定比之G+C百分比值要准确的多,是细菌分类学的一个发展方向。加之分子杂交技术的高敏感性,分子杂交在临床微生物诊断上具有广阔的前景。细菌的基因组大小约5×106bp,约含3000个基因。各种细菌之间绝大部分DNA是相同的,要获得某细菌特异的核酸探针,通常要采取建立细菌基因组DNA文库的办法,即将细菌DNA切成小片段后分别克隆得到包含基因组的全信息的克隆库。然后用多种其它菌种的DNA作探针来筛选,产生杂交信号的克隆被剔除,最后剩下的不与任何其它细菌杂交的克隆则可能含有该细菌特异性DNA片段。将此重组质粒标记后作探针进一步鉴定,亦可经DNA序列分析鉴定其基因来源和功能。因此要得到一种特异性DNA探针,常常是比较繁琐的。探针DNA克隆的筛选也可采用血清学方法,所不同的是所建DNA文库为可表达性,克隆菌落或噬斑经裂解后释放出表达抗原,然后用来源细菌的多克隆抗血清筛选阳性克隆,所得到多个阳性克隆再经其它细菌的抗血清筛选,最后只与本细菌抗血清反应的表达克隆即含有此细菌的特异性基因片段,它所编码的蛋白是该菌种所特有的。用这种表达文库筛选得到的显然只是特定基因探针。
对于基因探针的克隆尚有更快捷的途径。这也是许多重要蛋白质的编码基因的克隆方法。该方法的第一步是分离纯化蛋白质,然后测定该蛋白的氨基或羟基末端的部分氨基酸序列,然后根据这一序列合成一套寡核苷酸探针。用此探针在DNA文库中筛选,阳性克隆即是目标蛋白的编码基因。值得一提的是真核细胞和原核细胞DNA组织有所不同。真核基因中含有非编码的内含子序列,而原核则没有。因此,真核基因组DNA探针用于检测基因表达时杂交效率要明显低于cDNA探针。
DNA探针(包括cDNA探针)的主要优点有下面三点:①这类探针多克隆在质粒载体中,可以无限繁殖,取之不尽,制备方法简便。②DNA探针不易降解(相对RNA而言),一般能有效抑制DNA酶活性。③DNA探针的标记方法较成熟,有多种方法可供选择,如缺口平移,随机引物法,PCR标记法等,能用于同位素和非同位素标记。
(二)cDNA探针
cDNA(complementary DNA)是指互补于mRNA的DNA分子。cDNA是由RNA经一种称为逆转录酶(reverse transcriptase)的DNA聚合酶催化产生的,这种逆录酶是Temin等在70年代初研究致癌RNA病毒时发现的。该酶以RNA为模板,根据碱基配对原则,按照RNA的核苷酸顺序合成DNA(其中U与A配对)。这一途径与一般遗传信息流的方向相反,故称反向转录或逆转录。携带逆转录酶的病毒侵入宿主细胞后,病毒RNA在逆转录酶的催化下转化成双链cDNA,并进而整合人宿主细胞染色体DNA分子,随宿主细胞DNA复制同时复制。这种整合的病毒基因组称为原病毒。在静止状态下,可被复制多代,但不被表达,故无毒性。一旦因某种因素刺激而被活化,则该病毒大量复制,如其带有癌基因,还可能诱发细胞癌变,后来发现逆转录酶不仅普遍存在于RNA病毒中,而且哺乳动物的胚胎细胞和正在分裂的淋巴细胞也含有逆转录酶。逆转录酶的作用是以dNTP为底物,RNA为模板,tRNA(主要是色氨酸tRNA)为引物,在Trna3’-OH末端上,5’-3’方向,合成与RNA互补的DNA单链,称为互补DNA(cDNA),单链cDNA与模板RNA形成RNA-DNA杂交体。随后在逆转录酶的RNase H活性作用下,将RNA链水解成小片段。cDNA单链的3’末端回折形成一个小引物末端,逆转录酶又以第一条cDNA链为模板再合成第二第cDNA链,至此,完成逆转录全过程,合成双链cDNA。
逆转录现在已成为一项重要的分子生物学技术,广泛用于基因的克隆和表达。从逆转录病毒中提取的逆转录酶已商品化,最常用的有AMV逆转录酶。利用真核Mrna3’末端存在一段聚腺苷酸尾,可以合成一段寡聚胸苷酸(oligo(dT))用作引物,在逆转录酶催化下合成互补于mRNA的cRNA链,然后再用RNase H将mRNA消化掉,再加入大肠杆菌的DNA聚合酶I催化合成另一条DNA链,即完成了从mRNA到双链DNA的逆转录过程。
所得到的双链cDNA分子经S1核酸酶切平两端后接一个有限制酶切点的接头(linker),再经特定的限制酶消化产生粘性末端,即可与含互补末端的载体进行连接。常用的克隆载体是λ噬菌体DNA,如λgt,EMBL和Charon系列等。用这类载体可以得到包含104以上的转化子的文库,再经前面介绍的筛选方法筛选特定基因克隆。用这种技术获得的DNA探针不含有内含子序列。因此尤其适用于基因表达的检测。
(三)RNA探针
RNA探针是一类很有前途的核酸探针,由于RNA是单链分子,所以它与靶序列的杂交反应效率极高。早期采用的RNA探针是细胞mRNA探针和病毒RNA探针,这些RNA是在细胞基因转录或病毒复制过程中得到标记的,标记效率往往不高,且受到多种因素的制约。这类RNA探针主要用于研究目的,而不是用于检测。例如,在筛选逆转录病毒人类免疫缺陷病毒(HIV)的基因组DNA克隆时,因无DNA探针可利用,就利用HIV的全套标记mRNA作为探针,成功地筛选到多株HIV基因组DNA克隆。又如进行中的转录分析(nuclear run on transcrip-tion assay)时,在体外将细胞核分离出来,然后在α-32P-ATP的存在下进行转录,所合成mR-NA均掺入同位素而得到标记,此混合mRNA与固定于硝酸纤维素滤膜上的某一特定的基因的DNA进行杂交,便可反映出该基因的转录状态,这是一种反向探针实验技术。
近几年体外转录技术不断完善,已相继建立了单向和双向体外转录系统。该系统主要基于一类新型载体pSP和pGEM,这类载体在多克隆位点两侧分别带有SP6启动子和T7启动子,在SP6RNA聚合酶或T7RNA聚合酶作用下可以进行RNA转录,如果在多克隆位点接头中插入了外源DNA片段,则可以此DNA两条链中的一条为模板转录生成RNA。这种体外转录反应效率很高,在1h内可合成近10μg的RNA产生,只要在底物中加入适量的放射性或生物素标记的NTP,则所合成的RNA可得到高效标记。该方法能有效地控制探针的长度并可提高标记物的利用率。
值得一提的是,通过改变外源基因的插入方向或选用不同的RNA聚合酶,可以控制RNA的转录方向,即以哪条DNA链以模板转录RNA。这种可以得到同义RNA探针(与mRNA同序列)和反义RNA探针(与mRNA互补),反义RNA又称cRNA,除可用于反义核酸研究外,还可用于检测mRNA的表达水平。在这种情况下,因为探针和靶序列均为单链,所以杂交的效率要比DNA-DNA杂交高几个数量级。RNA探针除可用于检测DNA和mRNA外,还有一个重要用途,在研究基因表达时,常常需要观察该基因的转录状况。在原核表达系统中外源基因不仅进行正向转录,有时还存在反向转录(即生成反义RNA),这种现象往往是外源基因表达不高的重要原因。另外,在真核系统,某些基因也存在反向转录,产生反义RNA,参与自身表达的调控。在这些情况下,要准确测定正向和反向转录水平就不能用双链DNA探针,而只能用RNA探针或单链DNA探针。
综上所述,RNA探针和cRNA探针具有DNA探针所不能比拟的高杂交效率,但RNA探针也存在易于降解和标记方法复杂等缺点。
(四)寡核酸探针
前述三种探针均是可克隆的,一般情况下,只要有克隆的探针,就不用寡核苷酸探针。在DNA序列未知而必须首先进行克隆以便绘制酶谱和测序时,也常应用克隆。克隆探针一般较寡核苷酸探针特异性强,复杂度也高,从统计学角度而言,较长的序列随机碰撞互补序列的机会较短序列少,克隆探针的另一优点是,可获得较强的杂交信号,因为克隆探针较寡核苷酸探针掺入的可检测标记基因更多。但是,较长的探针对于靶序列变异的识别能力又有所降低。对于仅是单个碱基或少数碱基不同的两序列,克隆探针不能区分,往往杂交信号相当。这既是其优点,又是其缺点。优点是当用于检测病原微生物时,不会因病毒或细菌DNA的少许变异而漏诊,缺点则是不能用于点突变的检测。这种情况下,通常要采用化学合成的寡核苷酸探针。
合成的寡核苷酸探针具有一些独特的优点:①由于链短,其序列复杂度低,分子量小,所以和等量靶位点完全杂交的时间比克隆探针短,如20nt的寡核苷酸探针在浓度为100ng/ml,靶序列为1~100pg、1kb片段或3×10-18~3×10-16mol/L时,达到最大程度的杂交只需10min,而用2kb的克隆探针在同样条件下达到完全杂交则需16h。②寡核苷酸探针可识别靶序列内1个碱基的变化,因为短探针中碱基的错配能大幅度地降低杂交体的Tm值。③一次可大量合成寡核苷酸探针(1~10mg),使得这种探针价格低廉,与克隆探针一样,寡核苷酸探针能够用酶学或化学方法修饰以进行非放射性标记物的标记。尽管克隆探针较特异,但通过细心筛选序列和/或选择相对长的序列(>30nt)亦可设计出非常特异的寡核苷酸探针。最常用的寡核苷酸探针有18~40个碱基,目前的合成仪可有效地合成至少50个碱基的探针。下面是筛选寡核苷酸针的一些原则。
①长18~50nt,较长探针杂交时间较长,合成量低;较短探针特异性会差些。
②碱基成分:G+C含量为40%~60%,超出此范围则会增加非特异杂交。
③探针分子内不应存在互补区,否则会出现抑制探针杂交的“发夹”状结构。
④避免单一碱基的重复出现(不能多于4个),如-CCCCC-。
⑤一旦选定某一序更符合上述标准,最好将序列与核酸库中核酸序列比较,探针序列应与含靶序列的核酸杂交,而与非靶区域的同源性不能超过70%或有连续8个或更多的碱基的同源,否则,该探针不能用。
按上述原则选出的探针会增加成功的机会,选定后进行合成与标记,并摸索合适的杂交条件。方法是制备几张点有特异靶DNA和不相关DNA的膜,各膜分别在不同温度下与探针杂交,特异靶DNA杂交信号强而非特异DNA不产生任何杂交反应的就是最适杂交温度。在进行点突变检测杂交的反应时,洗膜条件和温度物选择往往更为重要。所选漂洗条件必需使野生型靶DNA与探针产生强的杂交信号而突变型靶DNA则不产生杂交信号,这可以通过逐渐提高洗膜温度来完成。
寡核苷酸探针还有一个重要用途。在用于检测单个碱基差异时尚可采用一种称为寡核苷酸限制(oligonucleotide restriction)的技术。该技术只有在突变点位于某一限制性内切酶识别位点时才有效。例如,镰刀状红细胞贫血是因β珠蛋白基因的第6个寡码子由GAG变成GTG,从而导致所编码氨基酸由酪氨酸变成缬氨酸。突变的β-珠蛋白功能异常,称作S珠蛋白,而野生型称为A珠蛋白,其基因型分别为βS和βA。恰好突变点A→T位于Del I的识别序列CT-NAG之内,这就为设计寡核苷酸限制实验创造了条件。方法是合成一个长40个碱基的寡核苷酸探针,其5’末端距突变碱基有11个碱基,该探针与βA基因的非编码链互补。将此探针的5’末端标记上32P。杂交方法采用液相杂交法,即在液相中将靶DNA变性解链,然后与探针退火,产生杂交体。如靶DNA为βA型,则两条链完全互补,并产生Dde I的酶切位点;如待检DNA为βS型,则所形成的杂交体中两条链在突变碱基处不配对,从而不能被Del I所识别。用Del I消化杂交DNA,显然βA会被切开而βS不被切开。βADNA杂交体被切开后,5’端探针序列因只有8个碱基,与杂交链结合不紧而解离,从而产生游离的5’端标记8核苷酸单链。不被切开的βS杂交体尚可被另一个限制酶Hinf I消化,该酶的识别位点紧靠Del I 识别位点上游。βS杂交DNA经Hinf I消化后,将释出探针DNA的5’末端3核苷酸小片段。βADNA杂交体因已无Hinf I识别序列,故而不能被Hinf I消化。这样βA和βSDNA经此寡核苷酸探针杂交和Del I及Hinf I消化后,分别产生游离的8核苷酸(8nt)和3核苷酸(3nt) 片段,它们可以经电泳分离后进行放射自显影而获证实。藉此策略,可轻易将各种β珠蛋白突变型鉴别开,如纯合野生型AA结果为仅有8nt片段,纯合突变型SS则仅可检出3nt片段,而杂合子AS型则两种片段均存在。
四、核酸探针的标记和检测(详见每十九章 )
分子杂交是核酸链间碱基配对规则的一种结合方式,是核酸的重要理化特性。利用分子杂交这一特性来对特定核酸序列进行检测,必须将杂交链中的一条用某种可以检测的分子进行标记,这条链就称为核酸探针。因此,核酸探针的制备是分子杂交技术的关键。最早采用的也是目前最常用的核酸探针标记方法是放射性同位素标记。常用的放射性同位素有32P和35S前者能量高,信号强,最常用。放射性同位素标记探针虽然敏感度高,但却存在辐射危害和半衰期限制(32P半衰期为14.3天,35S半衰期为87.1天,125I的半衰期为60天),3H的半衰期长达12.3年,但它所释放β放射线能量太低(0.018Mev),只能用于组织原位杂交。由于同位素标记的探针在使用过程中存在着上述缺点,近些年来,人们在寻找非航船性标记物方面取得了很大进展,国际上已有多家公司相继推出多种非放射性探针标记试剂盒,在国内也已具备生物素类标记物的生产能力,并有相应试剂出售。目前,非放射性标记物有下述几类:金属如Hg,荧光物质如FITC;半抗原如地高辛;生物素;酶类如辣根过氧化物酶(HRP)。半乳糖苷酶或碱性磷酸酶(AKP)等。不同的标记物,所标记探针的方法及检测方法也各异。下面仅就国际上较常用的,有实用价值或发展前景的几种核酸标记方法及其显示方法分两方面简述如下。
(一)核酸探针的常用酶促标记技术
1.缺口平移 该技术由Kelly等于1970年创立。其原理是首先用DNA酶在双链DNA探针分子的一条链上制造一些缺口(nick ),缺口处会形成3’—羟基末端,这时再在大肠杆菌DNA聚合酶I的催化下将核苷酸残基加在3’-羟基上,同时,根据大肠杆菌酶DNA聚合酶I的5’→3’核酸外切酶活性,此酶将缺口5’侧核苷酸依次切除。其结果是在缺口平移(nick tr-anslation)。根据这个原理,如果用高强度的放射性核苷酸(通常为α-32PdATP)置换先前存在的核苷酸,则可制备比活性高达108cpm(每分钟计数)/μg的32P标记DNA。用缺口平移法标记的DNA探针能满足大多数杂交要求。
2.DNA快速末端标记 大肠杆菌DNA聚合酶i 经枯草杆菌蛋白酶切割可得到两条多肽链,其中分子量为76kd的大片段称为Klenow片段。该酶具有完整聚合酶I的5’→3’聚合酶活性和3’→5’核酸外切酶活性,但缺乏5’→3’核酸外切酶活性。利用Klenow片段可以填补由限制酶消解DNA所产生的3’凹陷末端。因此,用这种方法可以标记双链DNA的凹陷3’末端。用Klenow片段标记末端一般只用一种[α-32P]dNTP,加入反应的[α-32P]dNTP取决于DNA末端延伸的5’末端序列,例如,用EcorI切割DNA所产生的末端用[α-32P]dNTP标记。标记反应可在一种限制酶消解DNA后立即进行,不需去除限制酶或使其失活,也不需更换缓冲液,具有3’延伸的DNA末端不能被Klenow片段有效在标记,欲标记这类分子可用T4DNA聚合酶。
选用这种标记方法是为了产生可用于凝胶电泳时作大小参照物的DNA片段。因为标记的DNA片段与其摩尔浓度成比例,而不与片段大小成比例,在限制酶消化物中,小的和大的片段都以相同程度被标记。因此,可使用放射自显影术确定不有被溴化乙锭染色所观察到的大小DNA带,尤其适用于Southern吸印杂交时分子量标志物的标记。通过选择相应标记的dNTP,该法还可以只标记DNA分子的一端。例如,若DNA片段的两个末端分别是Bam H I和Hind III 粘膜端,在反应中只加入[α-32P]dNTP或[α-32P]dGTP,使可选择性标记两末端之一。
3.用T4多核苷酸激酶标记DNa 5’末端 寡核苷酸探针或短的RNA和DNA探针可选用此法标记,寡核苷酸探针一般多用这种标记。T4多核苷酸激酶(polynucleotide kinase, PNK)是由T4噬菌体感染的大肠杆菌中提取的,此酶能催化ATP的γ-磷酸转移至DNA或RNA的5’-OH末端。在过量ADP存在时,也可促进磷酸交换反应,使PNK将DNA末端5’磷酸转移到ADP上生成ATP,然后催化[α-32P]dNTP上的标记磷酸转移至DNA的5’末端,从而使DNA重新磷酸化,并藉此得到标记。显然,PNK标记DNA末端需要[γ-32P]dNTP,这与前述酶促标记方法不同。通常,对于5’磷酸化的DNA探针,要先用碱性磷酸酶去掉磷酸基团,然后再用于PNK催化的5’末端标记,这样标记效率较高。
4.随机引物延伸 这是以单链DNA或RNA模板合成高比活性32P标记探针所选用的方法。原理是使长6~8nt的寡核苷酸片段与变性的DNA或RNA模板退火,在DNA聚合酶I或反转录酶的作用下,以每一个退火到模板上的寡核苷酸片段为引物引发DNA链的合成,在反应时将[α-32P]dNTP掺入合成链,即得到标记。变性处理后,新合成链(探针片段)与模板解离,即得到无数各种大小的探针DNA。因为所用寡核苷酸片段很短,在低温条件下可与模板DNA随机发生退火反应,因此被称为随机引物(random primer)。这种随机引物可用小牛胸腺DNA或鱼精DNA制备。
用随机引物法标记的DNA探针或cDNA探针比活性显著高于缺口平移法,且结果较为稳定。这种方法尤其适用于真核DNA探针,因为随机引物来自真核DNA,其与真核序列的退火率要高于原核序列。因此,对于克隆的DAN探针,常先将插入探针DNA切下来回收后再标记,而缺口平移法可直接用于全质粒的标记。
5.聚合酶链反应(详见第二十二章) 聚合酶链反应(polymerase chain reaction, PCR)是一种分子生物学新技术,由美国Cetus公司人类遗传学部的Kary.B. Mullis于1985年创立。该技术利用两个与相反链杂交并随着于靶DNA两侧的寡核苷酸引物经酶促合成特异的DNA片段,包括模板变性,引物退火和引物延伸三个步骤的反复循环,最终两引物所夹靶DNA得到千万倍以上的扩增。因此,PCR技术已成为一项极为有价值的技术并已迅速推广应用。
PCR技术有许多重要用途,其中之一便是可用来标记高比活性DNA探针。PCR技术具有很高的特异性,可在1~2h之内在量合成探针DNA片段,如果在底物中加入[α-32P]dNTP或其它标记的dNTP,则探针DNA合成过程中可得到很好的标记,标记物的掺入率可高达70%~80%。因此,PCR标记技术特别适用于大规模检测和非放射性标记。该法的缺点是要合成一对特异性PCR引物。使用从探针DNA上制备的小片段作引物也能取得较好的标记效果。
(二)核酸探针的非放射性标记技术
1.光敏生物素标记核酸 目前使用的光标生物素试剂有两种:光生物素(乙酸盐)和补骨脂素生物素。它们都是由一个光敏基团、一个连接臂和一个生物素基团组成。光生物素的光敏基团是-N3,它在光作用下可与核酸中的碱基结合。补骨脂素生物素中的光敏基团补骨脂素在光照(320~400μm)下,可与单链或双链核酸发生反应,反应主要在T上,C上也有一定程度的反应。光敏生物素的连接臂含6~12个碳原子,用以减少探针杂交时的空间位阻。光敏生物素标记核酸,方法简单,灵敏度也可达到pg水平,可用于外源基因的检测。最近出现了一种新的光敏活性DNA生物素试剂,即生物素-聚乙二醇-当归素(BPA)。BPA的DNA结合部分是一个活性糖香豆素衍生物,在长波UV下它可与DNA碱基共价键结合。BPA反应物与DNA结合比光敏生物素更特异,在可见光下它不与核酸反应,这个特性可使BPA只标记粗制细胞裂解物中的核酸,而不标记蛋白、多糖和其他细胞大分子。
2.酶促生物素标记核酸 以生物素化的脱氧核苷三磷酸(Bio-11-dUTP,Bio –7 – dATP、Bio-11-dCTP)等代替相应32P标记的脱氧核苷三磷酸,经DNA聚合酶作用掺入DNA。Bio-dUTP代替dTTP,Bio-dATP代替dATP,Bio- dCTP代替dCTP。Bio –11-dUTP的11是指生物素基团与脱氧核苷酸之间连接臂的碳链长度。常用的酶促生物素标记DNA的方法有缺口平移法和随机引物延伸法。
3.寡核苷酸的生物素末端标记 有5’-磷酸的化学标记法和3’-OH的酶促标记法。前者将寡核苷酸的5’-磷酸接上一个乙二胺,然后用琥珀酰亚胺生物素,将生物素基团连接在磷酸酰胺基上。后者是用末端转移将Bio-11–dUTP加于其3’-OH端(脱去一个焦磷酸)。
4.酶标DNA 标记试剂是辣根过氧化酶(HRP)或碱性磷酸酶(AP)。通过对苯醌(PBQ)与聚乙烯亚胺(PEI)连接而成(HRP-PBQ-PEI+),此试剂在戊二醛的作用下与变性的DNA结合,使HRP与DNA连接在一起,组成HRP标记的DNA探针。
5.酶标寡核苷酸 包括核苷酸5’末端标记HRP法和内部标记AP法。前者是在HRP中产生一个-HS反应基团,在寡核苷酸合成终了加在5’端,带一个C6的-HS基,与活化的HRP反应生成5’-HRP寡核苷酸。后者是在全成寡核苷酸过程中将一个5’带连接臂及CF3基团的尿苷3’亚磷酰亚胺合成在寡核苷酸链中,合成后此活化的寡核苷酸与AP反应即得到AP标记的寡核苷酸。
6.DNA半抗原标记 其原理与Bio-11-dTUP相同,只是用毛地黄甙代替生物素形成Dig –11- dUTP,酶促掺入DNA分子。用抗毛地黄甙抗体检测标记在DNA上的半抗原分子Digoxigenin(地高辛)
(三)非放射性探针的显示体系
1.AP显色体系
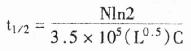
BCI –OH+NBT→紫色↓
ASO:等位基因特异的寡核苷酸,BCIP:5溴-4氯-3吲哚磷酸,NBT:四氮唑蓝,Pi:磷酸。
2.HRP显色体系
HRP + H2O2[HRP·H2O2]
ODA –NH2 +[HRP ·H2O2]枣→ODA-N = ODA/棕色↓+HRP +H2O
ODA:邻-联茴香胺。
3.ABC显色体系
DNA –B+ SA – AP→DNa – B – SA或DNa – B +SA - BAP→DNa –B –SA –BAP
经上述两反应,把AP连接在DNA上以后,再进行AP酶显色。这里SA为Streptavidin(链酶亲合素),BAP为生物素化的磷酸酶,B为生物素(biotin),ABC为Avidin – Biotin - Enzyme com-plex, 即亲合素- 生物素-酶复合物。
以上反应AP亦可用HRP代替。
表18-3曱核酸探针的标记分子
| 标记物性质 | 标记分子 | 标记方法 | 杂交体的检测法 |
| 放射性分子 | [α-32P]dNTP | NT、PCR、RPI | 放射自显影或计数 |
| [γ-32P]dNTP | TL | 放射自显影或计数 | |
| 125I | 碘化 | 放射自显影或计数 | |
| 35S | NT | 放射自显影或计数 | |
| 3H | NT | 放射自显影或计数 | |
| 非放射性分子 | |||
| 生物素 | Bio-11-dUTP | NT、TL、PCR | 酶标亲合素或酶标抗生物素抗体显色 |
| 光敏生物素 | 600W 可见光照 | 同上 | |
| 生物素化补骨脂素 | 365nm紫外线照 | 同上 | |
| 生物素酰-e-氨基乙酸 | 化学合成法 | 同上 | |
| N-羟基丁二酰亚胺脂 | 酶标亲合素或酶标抗生物素抗体显色 | ||
| 生物素肼 | 化学合成法 | 酶标亲合素或酶标抗生物素抗体显色 | |
| 酶 | 微过氧化物酶 | 直接法或合成法 | 直接底物显色或用酶标抗体+ 底物显色 |
| 碱性磷酸酯酶 | 直接法或合成法 | 同上 | |
| 荧光素 | 罗丹明和FITC | 合成法 | 直接荧光显微镜观察或酶标抗体+ 底物显色 |
| 化学发光标记物 | 化学发光测量或自显影 | ||
| 抗双链单抗 | 酶标或荧光标记单抗 | 化学法 | 直接底物显色 |
| 稀有金属 | Eu3- | 化学法 | 时间分辨荧光 |
| 重金属 | Ag | 化学法 | |
| Hg | 化学法 | ||
| 半抗原 | 磺酸胞嘧啶 | 化学法 | 酶标单抗 + 底物显色 |
| 地高辛 | RPL | 酶标抗体 + 底物显色 |
* :NT:缺口平移; PCR:聚合酶链反应;RPL: 随机引物标记; TL:末端标记
4.非放射发光自显影若将AP或HRP的显色底物根据光化学原理换成一种酶解后产生光子的化合物,可用自显影技术暴光X线片显示。
(1)HRP发光自显影:氨基苯-甲酰肼在HRP与H2O2的作用下氧化为氨基苯二甲酸,同时放出N2及发光(波长428nm)。发光时加入某些酚的衍生物时可增强发光上千倍。反应如下图:
(2)AP的发光自显影:AP的发光底物是金刚烷二氧丁环磷酸盐(AMPPD),它含有磷酸酯键在AP的作用下水解下一个磷酸,进而由分子内过氧键提供能源分解产生金刚酮和激发态的甲基间-氧苯甲酸阴离子,当此阴离子恢复到基态时发出光子。可用波拉黑白片(621型)直接暴光显影。显影信号强度比BCIP/NBP显色法强两上数量级。是很前景的显示体系。
其发光反应的原理如下:
HRP的发光原理:
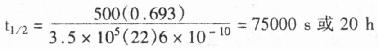
AP的发光原理:
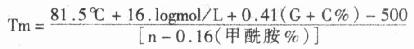
五、核酸分子杂交的类型
随着基因工程研究技术的迅猛发展,新的核酸分子杂交类型和方法在不断涌现和完善。核酸分子杂交可按作用环境大致分为固相杂交和液相杂交两种类型。固相杂交是将参加反应的一条核酸链先固定在固体支持物上,一条反应核酸游离在溶液中。固体支持物有硝酸纤维素滤膜、尼龙膜、乳胶颗粒、磁珠和微孔板等。液相杂交所参加反应的两条核酸链都游离在溶液中。
由于固相杂交后,未杂交的游离片段可容易地漂洗除去,膜上留下的杂交物容易检测和能防止靶DNA自我复性等优点,故该法最为常用。常用的固相杂交类型有:菌落原位杂交、斑点杂交、狭缝杂交、Southern印迹杂交、Northern印迹杂交、组织原位杂交和夹心杂交等。
液相杂交是一种研究最早且操作复合的杂交类型,在过去的30年里虽有时被应用,但总不如固相杂交那样普遍。其主要原因是杂交后过量的未杂交探针在溶液中除去较为困难和误差较高。近几年由于杂交检测技术的不断改进,商业性基因探针诊断盒的实际应用,推动了液相杂交技术的迅速发展。下面对固相杂交和液相杂交分别进行介绍。
(一)固相膜核酸分子杂交方法
固相核酸杂交多是在膜上进行,因此,以下主要介绍固相膜的核酸分子杂交方法:
1.DNA的变性 DNA变性解链是杂交成功的关键。Southern印迹杂交时DNA在凝胶中变性,变性方法是将凝胶浸在数倍体积的1.5mol/l NaCl和0.5mol/l NaOH中1h然后用数倍体积的1mol/l Tris –HCl(Ph8.0)和1.5mol/l NaCl溶液中和1h。DNA受酸、碱、热等处理均能发生变性,但强酸会使核酸降解。一般认为碱变性较好,可避免DNA降解。热变性在要低DNA浓度(100μg/ml)和低盐浓度(0.1mol/l SSC 含15mmol/l NaCl - 1.5mmol/L柠檬酸三钠,pH7.0)下进行。用SSC稀释DNA溶液为50μg/ml,加10mol/l NaOH使最终浓度为0.1mol/L(pH约12.8),室温变性10min,很快置冰盐水中,用10min/l HCl或5mol/l NaH2PO4调pH到7~8[亦可用碱变性后,调至中性,再加热100。c 10min],DNA变怀可用OD260增加(约30%~40%)来检测,变性DNA醇沉淀呈雪样,完全失去纤维状沉淀。变性后加入等量冷的12×SSC,冰浴保存。
2.变性DNA在硝酸纤维素膜上的固定 硝酸纤维素滤膜(孔径0.45μm)先在蒸馏水中充分浸泡,再用6×SSC浸泡30min~2h,凉干。DNA样品转移或加至硝酸纤维素膜上后,先室温干燥4h,然后在80。C真空干燥2h。
3.预杂交 湿润的滤膜放入可加热封口的塑料袋中,按每平方厘米滤膜加0.2ml预热至60。C的预杂交液(6×SSC,0.5%,SDS,5×Denhardt液,100μg/ml鲑鱼精DNA)。鲑鱼精DNA需经过剪切和DNA酶消化处理,然后酒精沉淀纯化,调浓度至10mg/ml,用前放100。C水浴中煮沸变性10min,冰水骤冷。尽可能将袋中气泡赶尽,可封口器将袋口封住。将杂交袋浸入68。C水浴保温3~12h。当预杂交液温度升至68。C时,在滤膜表面常会形成小气泡。轻轻晃动袋中液体即可除去这些小气泡,这一点对于保证滤膜表面充分浸润预杂交液很重要。
4.杂交 从水浴中取出塑料袋,用剪刀剪开一角,尽可能挤净预杂交液。用吸管或大枪头将杂交液加入袋中,用恰好是足量的液体保持滤膜湿润(50μl/cm2)。溶液的组成是6×SSC,0.01mol/l EDTA, 变性的标记核酸探针,5×Denhardt液,0.5%SDS, 100μg/ml变性的鲑鱼精DNA。尽可能赶尽气泡后,将塑料袋严密封口,杂交反应在68℃水浴中进行,所需时间视探针和检测靶DNA的性质及探针的比活性等情况而定,一般4~20h。
5.洗膜 取出塑料袋,用剪刀剪开,小心取出滤膜,立即浸入盛有2×SSC和0.5%SDS溶液的盘中,室温下漂洗5min。再将滤膜移入2×SSC和0.1%SDS溶液中,室温下洗涤15min(轻轻摇动)。然后将滤膜移入0.1×SSC和0.5%SDS溶液中;68℃轻轻摇动保温2h,更换缓冲液后继续保温30min。
洗膜的温度一般应控制在低于Tm值12℃以上。(Tm = 69.3 + 0.41x(G +C) %)。双链DNA的Tm值随错配碱基对数每增加1%而递减1℃。
6.结果显示 非放射性检测方法前已述及,此处主要介绍放射性测定方法。固相膜的放射性杂交结果显示有两种方式,一是放射性自显影法,另一种是液闪计数法。前一种方法比较简单,只需将杂交膜与X光片在暗盒中曝光数小时至数天,再显影、定影即可。对于杂交信号较弱的固相膜,用一块增感屏可显著增强曝光强度。此外,为了减弱32P的散射,曝光通常在-20℃或-80℃下进行。液闪计数法主要用于打点和狭缝杂交及为了比较两个杂交信号的强弱等情形。方法是将完成杂交的膜在漂洗结束后剪成小块(每份样品1块),80℃真空干燥后装闪烁瓶。加入2~5ml闪烁液,剪2~3块无样品膜块作为本底对照。在液体闪烁计数器上自动计数。液体计数测定放射性强度也可在放射自显影之后进行。
(二)固相核酸分子杂交类型
1.菌落原位杂交(Colonyin situ hybridization) 菌落原位杂交是将细菌从培养平板转移到硝酸纤维素滤膜上,然后将滤膜上的菌落裂菌以释出DNA。将NDA烘干固定于膜上与32P标记的探针杂交,放射自显影检测菌落杂交信号,并与平板上的菌落对位。
实验步骤如下:
①将硝酸纤维素滤膜置于含抗生素的平皿琼脂培养基上,用无菌牙签挑取单菌落种于滤膜和主琼脂平板上,排列成方格栅,膜和板上菌落位置相同。
②培养细菌至产生1~2mm大小的菌落。
③在一块平皿中置4张滤纸,用10%SDS浸透,倒掉多余液体。将带有菌落的滤膜取下,轻轻置于滤纸上,菌落面上在,注意防止在滤膜底面存有气泡。
④5min后,将滤膜转至用变性溶液(0.5mol/l NaCl , 0.5mol/L Tris·NaCl)浸湿的滤纸上,放置10min。
⑤将滤膜转至中和溶液(1.5mol/lNaCl , 0.5mol/L Tris·HCl ,pH8.0)浸湿的滤纸上,放置10min。重复中和1次。
⑥将滤膜移至用2×SSPE溶液浸过的滤纸上,放置10min。SSPE配成20×贮备液:3.6mol/l NaCl, 0.2mol/L NaH2PO4(PH7.4), 20mmol/L EDTA(pH7.4)。
⑦将滤膜用滤纸吸干,80℃真空烘干2h。
以下操作参考前述。
2.斑点杂交(Dot blot)斑点杂交法是将被检标本点到膜上,烘烤固定。这种方法耗时短,可做半定量分析,一张膜上可同时检测多个样品。为使点样准确方便,市售有多种多管吸印仪(manifolds),如Minifold I和II、Bio-Dot (Bio –Rad )和Hybri –Dot,它们有许多孔,样品加到孔中,在负压下就会流到膜上呈斑点状或狭缝状,反复冲洗进样孔,取出膜烤干或紫外线照射以固定标本,这时的膜就可以进行杂交。
(1)DAN斑点杂交
①先将膜在水中浸湿,再放到15×SSC中。
②将DNA样品溶于水或TE,煮沸5min,冰中速冷。
③用铅笔在滤膜上标好位置,将DNA点样于膜上。每个样品一般点50μl(2~10μg DNA)。
④将膜烘干,密封保存备用。
(2)RNA斑点杂交:与上法类似,每个样品至多加10μg总RNA(经酚/氯仿或异硫氰酸胍提取纯化)。方法是将RNA溶于5μlDEPC水,加15μl甲醛/SSC缓冲液(10×SSC中含0.15mol/l甲醛)使RNA变性。然后取5~8μl点样于处理好的滤膜上,烘干。
培养细胞,标本处理技术可以简化,不用提取和纯化RNA。方法是用含0.5%Nonidet P40的低渗缓冲液对多种动物细胞作简单处理,离心去掉细胞核和细胞碎片,就得到基本不带DNA而富含RNA的细胞质提取物,这一粗RNA在高盐下用甲醛变性,不需加工直接点到硝酸纤维素膜上。本法可以快速检测大量标本,而只需极少量的细胞(5×104)或组织。
整个RNA实验中,要防止激活内源性RNase,有许多种预防措施,有一种是在样品中加入核糖核苷氧矾基复合物(RVC)。
(3)完整细胞斑点杂交:应用类似检测细菌菌落的方法,可以对细胞培养物的特异序列进行快速检测。将整个细胞点到膜上,经NaOH处理,使DNA暴露、变性和固定,再按常规方法进行杂交与检测。有人曾用此法从105个培养细胞中检测到少至5pg 的Epstein– Barr病毒DNA。完整细胞斑点印迹法可以用于筛选大量标本,因为它是使细胞直接在膜上溶解,所以DNA含量甚至比常用的提取法还高,又不影响与32P标记的探针杂交。但它不适于非放射性标记探针,因为DNA纯度不够,会产生高本底。
3.Southern印迹杂交(southern blot )Southern blot 是研究DNA图谱的基本技术,在遗传诊断DNA图谱分析及PCR产物分析等方面有重要价值。Southern印迹杂交基本方法是将DNA标本用限制性内切酶消化后,经琼脂糖凝胶电泳分离各酶解片段,然后经碱变性,Tris缓冲液中和,高盐下通过毛吸作用将DNA从凝胶中转印至硝酸纤维素滤膜上,烘干固定后即可用于杂交。凝胶中DNA片段的相对位置在DNA片段转移到滤膜的过程中继续保持着。附着在滤膜上的DNA与32P标记的探针杂交,利用放射自显影术确定探针互补的每条DNA带的位置,从而可以确定在众多酶解产物中含某一特定序列的DNA片段的位置和大小。
(1)琼脂糖凝胶电泳:利用琼脂糖凝胶电泳可以很容易地将DNA限制酶消化片段(0.3~25kb)分离开。分离大分子DNA片段(800~12000bp)用低浓度琼脂糖(0.7%),分离小分子片段(500~1000bp)用高浓度琼脂糖(1.0%),300~5000bp的片段则用1.3%的琼脂糖凝胶,根据分离样品量、分离速度和分辨率要求的不同,可选用不同规格的电泳槽。
电泳时,同时将标记物加到旁边孔中,便于确定样品DNA的分子量。20伏恒压电泳过夜。电泳毕,将胶浸到含0.5μg/ml EB的TBE缓冲液中染色30min,也可将EB直接加到电泳缓冲液中或在配胶前加入胶中,在254nm短波透射灯下拍照,加橙黄色滤色镜,使用高速一次成像胶片,光圈f4.5,曝光20~40s。
(2)硝酸纤维素滤膜吸印。
①将胶切成合适大小,切去右上角作为记号。
②将胶放进盛有变性缓冲液(1.5mol/lNaCl, 0.5mol/L NaOH)的盘中轻摇动15min。
③换到中和缓冲液(1mol/LTris·HCl , pH8.0, 1.5mol/L NaCl)中轻摇动30min。
④裁一张硝酸纤维素膜,2~4张3MM滤纸和一些吸印纸(可用卫生纸),都与胶的大小相同(硝酸纤维素膜和吸印纸不能比胶大,否则易形成旁路),先将硝酸纤维素膜浸到水中,再放入10×SSC中,接触胶和硝酸纤维素膜时都要戴橡胶手套操作。
⑤平盘上放一块比胶大的平板(盛胶槽翻过来即可),上面铺一张3MM滤纸,起灯芯作用,盘中加少量10×SSC缓冲液(2.5cm厚),不能没过平板,使3MM滤纸充分饱和。
⑥将胶倒扣到3MM滤纸上。
⑦浸湿的硝酸纤维素铺在胶上,对齐,铺膜时从一边逐渐放下,防止产生气泡,有气泡时,可用吸管赶出,不能让膜与胶下的滤纸直接接触。
⑧膜上放一张3MM滤纸,不能与胶接触。
⑨上面加吸印纸及重物(500g左右)。
⑩通过滤纸的灶芯作用,平盘中的缓冲液就会通过胶上移,从而将DNA吸印到膜上,及时更换浸湿的吸印纸。在室温下转印过夜。
⑾去除上面的东西,用镊了将膜取出,在6×SSC中洗一下(也可不洗)。
⑿自然干燥,80℃烤2h。
⒀这时的膜就可进行杂交,或室温密封保存。
4.Northern印迹杂交(Northern blot) 这是一种将RNA从琼脂糖凝胶中转印到硝酸纤维素膜上的方法。DNA印迹技术由Southern于1975年创建,称为Southern印迹技术。RNA印迹技术正好与DNA相对应,故被趣称为Northern印迹杂交,与此原理相似的蛋白质印迹技术则被称为western blot。Northern印迹杂交的RNA吸印与Southern印迹杂交的DNA吸印方法类似,只是在进样前用甲基氧化汞、乙二醛或甲醛使RNA变性,而不用NaOH,因为它会水解RNA的2’-羟基基团。RNA变性后有利于在转印过程中与硝酸纤维素膜结合,它同样可在高盐中进行转印,但在烘烤前与膜结合得并不牢固,所以在转印后不能用低盐缓冲液洗膜,否则RNA会被洗脱。在胶中不能加EB,因它为影响RNA与硝酸纤维素膜的结合,为测定片段大小,可在同一块胶上加标记物一同电泳,之后将标记物胶切下,上色、照像。样品胶则进行Northern转印,标记物胶上色的方法是在暗室中将其浸在含5μg/ml EB的0.1mol/L 醋酸铵中10min,在水中就可脱色。在紫外光下用一次成像相机拍照时,上色的RNA胶要尽可能少接触紫外光,若接触太多或白炽灯下暴露过久,会使RNA信号降低。从琼脂糖凝胶中分离功能完整的mR-NA时,甲基氢氧化汞是一种强力、可逆变性剂,但是有毒,因而许多人喜用甲醛作为变性剂。所有操作均应避免RNase的污染。
下面介绍RNA甲醛凝胶电泳和吸印方法:
(1)试剂
10×MSE缓冲液:0.2mol/L 吗啉代丙烷磺酸(MOPS),pH7.0, 50mmol/L 醋酸钠,1mmol/l EDTA, pH8.0。
5×样品缓冲液:50%甘油,1mmol/l EDTA, 0.4%溴酚蓝。
甲醛:用水配成37%浓度(12.3mol/L)。应在通风柜中操作,pH高于4.0。
去离子甲酰胺。
50mmol/L NaOH(含10mmol/l NaCl)。
0.1mol/L Tris·HCl,Ph7.5。
(2)步骤
①40ml水中加7g琼脂糖,煮沸溶解,冷却到60℃,加7ml 10×MSE缓冲液、11.5ml甲醛,加水定容 至70ml,混匀后 倒入盛胶槽。
②等胶凝固后,去掉梳子和胶布,将盛胶槽放入1×MSE缓冲液的电泳槽。
③使RNA变性(最多20μg):RNa 4.5μl,10×MSE缓冲液2.0μl,甲醛3.5μl,去离子甲酰胺10.0μl。
④55℃加热15min,冰浴冷却。
⑤加2μl 5×载样缓冲液。
⑥上样,同时加RNA标记物。
⑦60伏电泳过夜。
⑧取出凝胶,水中浸泡2次,每次5min。
⑨室温下将胶浸到50mmol/LNaOH和10mmol/l NaCl中45min,水解高分子RNA,以增强转印。
⑩室温下将胶浸到0.1mol/LTris·HCl (Ph7.5)中45min,使胶中和。
⑾20×SSC洗胶1h。
⑿20×SSC中过夜,转印到硝酸纤维素膜上。
⒀取出硝酸纤维膜,80℃真空烘烤2h。
5.组织原位杂交(Tissuein situ hybridization) 组织原位杂交简称原位杂交,指组织或细胞的原位杂交,它与菌落的原位杂交不同。菌落原位杂交需裂解细菌释出DNA,然后进行杂交。而原位杂交是经适当处理后,使细胞通透性增加,让探针进入细胞内与DNA或RNA杂交。因此原位杂交可以确定探针的互补序列在胞内的空间位置,这一点具有重要的生物学和病理学意义。例如,对致密染色体DNA的原位杂交可用于显示特定的序列的位置;对分裂期间核DNA的杂交可研究特定序列在染色质内的功能排布;与细胞RNA的杂交可精确分析任何一种RNA在细胞中和组织中的分布。此外,原位杂交还是显示细胞亚群分布和动向及病原微生物存在方式和部位的一种重要技术。
用于原位杂交的探针可以是单链或双链DNA,也可以是RNA探针。通常探针的长度以100~400nt为宜,过长则杂交效率减低。最近研究结果表明,寡核苷酸探针(16~30nt)能自由出入细菌和组织细胞壁,杂交效率明显高于长探针。因此,寡核苷酸探针和不对称PCR标记的小DNA探针或体外转录标记的RNA探针是组织原位杂交的优选探针。
探针的标记物可以是放射性同位素,也可以是非放射性生物素和半抗原等。放射性同位素中,3H和35S最为常用。3H标记的探针半衰期长,成像分辨率高,便于定位,缺点是能量低。35S标记探针活性较高,影像分辨率也较好。而32P能量过高,致使产生的影像模糊,不利于确定杂交位点。
原位杂交中,标本的固定条件是影响杂交效率的重要因素,标本组织蛋白质的消化程度对探针进入细胞极为重要。去除蛋白的方法是,用0.2mol/l HCl处理载玻片,用蛋白酶K消化,然后用不同浓度的乙醇脱水,原位杂交还是一种新技术,发展很快,在敏感性、特异性和稳定性上还需要进一步完善和提高(详见二十章 )。
6.固相夹心杂交Dunn等最早介绍了夹心杂交类型,Ranki等又作了进一步的改进。夹心杂交法比直接滤膜杂交法有两个主要的优点:①样品不需要固定,对粗制样品能做出可靠的检测;②用夹心杂交法比直接滤膜杂交法特异性强,因为只有两个杂交物都杂交才能产生可检测的信号。
固相夹心杂交需要两个靠近而不互相重叠的探针,一个作固相吸附探针,另一个作标记检测探针。样品基因组内核酸只有使这两个探针紧密相连才能形成夹心结构。需注意的是两个探针必须分别亚克隆进入两个分离的非同源载体内,以避免产生高的本底信号(如一个克隆人Puc19,另一克隆人pBR322)。
夹心杂交法可用滤膜和小珠固定吸附探针,使用小珠可更好地进行标准化试验和更容易对小量样品进行操作。Dahlen 等利用微孔板进行夹心杂交,可同时进行大量样品检测,他们先吸取DNA探针加到凹板中,然后用紫外线照射使其固定到塑料板上。用微孔板进行夹心杂交还可直接用于PCR技术。应用光敏生物标记探针检测PCR产物的敏感性和用32P标记探针(3×108cpm/μg)作16h放射自显影的Southern杂交的敏感性一样。用微孔板杂交的其它优点还包括同时做多份样品,加样、漂洗和读结果等步骤可以自动化。
7.其它杂交类型
(1)固化探针杂交:该法较少使用,原理是使未标记固化探针通过杂交与靶RNA或DNA结合,漂洗后,用酶标抗DNA:RNA抗体或抗DNA:DNA抗体与杂交物结合。将乳胶颗粒收集,吸附到膜上后漂洗,加入底物显色并进行测定。探针浓度2μg/ml,80℃杂交,可在10~15min完成,检测的敏感性为5×108靶序列。
(2)反向杂交:这个杂交类型是用标记的样品核酸与未标记的固化探针DNA杂交,故称为“反向杂交”。这种杂交方法的优点是在一次杂交反应中,可同时检测样品中几种核酸。这种杂交方式主要用于进行中的核酸转录试验和多种病原微生物的检测。前者是在转录过程中标记RNA探针,后者可用光敏生物素制剂BPA标记样品核酸。
(三)固相膜核酸杂交的几点说明
1.杂交膜的选用杂交膜是一种多孔、表面积很大的固相载体,核酸一旦固定在上面,就可用杂交法进行检测。最常使用的膜是硝酸纤维素膜,用于放射性和非放射笥标记探针都很方便,产生的本底浅,与核酸结合的化学性质不是很清楚,推测为非共价键结合。经80℃烤干2h和杂交处理后,核酸仍不会脱落。硝酸纤维素膜的另一特点是只与蛋白有微弱非特异结合,这在使用非同位素探针中尤为有用。硝酸纤维素膜的缺点是结合核酸能力的大小取决于转印条件和高浓度盐(>10×SSC),与小片段核酸(<200bp)结合不牢,质地脆,不易操作。
尼龙膜在某些方面比硝酸纤维素膜好,它的强度大、耐用,可与小至10bp的片段共价结合。在低离子浓度缓冲液等多种条件下,它们都可与DNA单链或RNA紧密结合,且多数膜不需烧烤。尼龙膜韧性好,可反复处理与杂交,而不丢失被检标本。它通过疏水键和离子键与核酸结合,结合力为350~500μg/cm2,比硝酸纤维素膜(80~100μg/cm2)强许多。尼龙膜的缺点是对蛋白有高亲合力,不宜使用非同位素探针。
2.“噪音”的排除“噪音”(noise)是固相膜杂交方法常遇到的问题,指标记DNA结合到空白膜上的放射性计数,即本底。这个问题的克服一是使用高纯度的核酸制品和充分严格的杂交条件:二是选择合适的杂交反应液和对膜进行处理。研究发现,随着离子强度的增加,空白膜(未固定DNA对照膜)上的“噪音”水平增加,而在50%甲酚胺6×SSC的杂交反应液中充分封闭膜上的多余非特异结合位点。
(四)液相核酸分子杂交类型
1.
(1)HAP吸附杂交:羟基磷灰石(HAP)层析或吸附是液相杂交中最早使用的方法。在液相中杂交后,DNA:DNA杂交双链在低盐条件可特异地吸附到HAP上。通过离心使吸附有核酸双链的HAP沉淀,再用缓冲液离心漂洗几次HAP,然后将HAP置于计数器上进行放射性计数。
(2)亲合吸附杂交:生物素标记DNA探针与溶液中过量的靶RNA杂交,杂交物吸附到酰化亲合素包被的固相支持物(如小球)上,用特异性抗DNA:RNA杂交物的酶标单克隆抗体与固相支持物上的杂交物反应,加入酶显色底物,这个系统可快速(2h)检测RNA。
(3)磁珠吸附杂交:Gen– probe公司最近应用吖啶翁酯(acridinium ester)标记DNA探针,这种试剂可用更敏感的化学发光来检测。探针和靶杂交后,杂交物可特异地吸附在磁化的有孔小珠(阳离子磁化微球体上)。溶液中的磁性小珠可用磁铁吸出,经过简单的漂洗步骤,吸附探针的小珠可用化学发光测定。
2.发光液相杂交
(1)能量传递法:Heller等设计用两个紧接的探针,一个探针的一端用化学发光基团(供体)标记,另一个探针的一端用荧光物质标记,并且这两个探针靠得很近。两个靠得很近的探针用不同的物质标记(标记光发射),当探针与特异的靶杂交后,这些标记物靠得很近。一种标记物发射的光被另一种标记物吸收,并重新发出不同波长的光,调节 检测器使自动记录第二次发射光的波长。只有在两个探针分子靠得近时,才能产生受激发光,因此这种方法具有较好的特异性。
(2)吖啶翁酯标记法:吖啶翁酯标记探针与靶核酸杂交后,未杂交的标记探针分子上的吖啶翁酯可以用专门的方法选择性除去,所以杂交探针的化学发光是与靶核酸的量成比例的。该法的缺点是检测的敏感度低(约1ng的靶核酸),仅适用于检测扩增的靶序列,如rRNA或PCR扩增产物。
3.液相夹心杂交
(1)亲合杂交:在靶核酸存在下,两个探针与靶杂交,形成夹心结构,杂交完成后,杂交物可移到新的管或凹孔中,在其中杂交物上的吸附探针可结合到固相支持物上,而杂交物上的检测探针可产生检测信号。用生物素标记吸附探针,用125I标记检测探针,这个系统的敏感性可检测出4×106靶分子。该试验保持了固相夹心杂交的高度特异性。
(2)采用多组合成探针和化学发光检测:第一类探针是未标记的检测探针和液相吸附探针,它们有50个碱基长,其中含有30个细菌特异序列碱基和20个碱基的单链长尾;第二类探针是固相吸附探针,它可吸附在小珠或微孔板上。未标记检测探针的单链长尾用于结合扩增多个标记探针,液相吸附探针和靶杂交物从溶液中分离并固定在小珠或微板上,典型的试验可用25个不同的检测探针和10个不同的吸附探针。第一个标记检测探针上附着很多酶(碱性磷酸酶或过氧化物酶)可实现未标记检测探针的扩增。使用化学发光酶的底物比用显色反应酶的底物更敏感。这个杂交方法已用于乙肝病毒、沙眼衣原体、淋球菌以及质粒抗性的检测,敏感性达到能检测5×104双链DNA分子。
4.复性速率液相分子杂交这个方法的原理是细菌等原核生物的基因组DNA通常不包含重复顺序。它们在液相中复性(杂交)时,同源DNA比异源DNA的复性速度要快。同源程度越高,复性速率和杂交率越快。利用这个特点,可以通过分光光度计直接测定变性DNA在一定条件下的复性速率,进而用理论推导的数学公式来计算DNA-DNA之间的杂交(结合)度。
六、核酸分子杂交实验因素的优化
(一)探针的选择
根据不同的杂交实验要求,应选择不同的核酸探针。在大多数情况下,可以选择克隆的DNA或cDNA双链探针。但是在有些情况下,必须选用其它类型的探针如寡核苷酸探针和RNA探针。例如,在检测靶序列上的单个碱基改变时应选用寡核苷酸探针,在检测单链靶序列时应选用与其互补的DNA单链探针(通过克隆人M13噬菌体DNA获得)或RNA探针,寡核苷酸探针也可。长的双链DNA探针特异性较强,适宜检测复杂的靶核苷酸序列和病原体,但不适宜于组织原位杂交,因为它不易透过细胞膜进入胞内或核内。在这种情况下,寡核苷酸探针和短的PCR标记探针(80~150bp)具有较大的优越性。
在选用探针时经常会受到可利用探针种类的限制。如在建立DNA文库时,手头没有筛选特定基因的克隆探针,这时就可用寡核苷酸探针来代替。但必须首先纯化该基因的编码蛋白,并测定6个以上的末端氨基酸序列,通过反推的核苷酸序列合成一套寡核苷酸探针。如果已有其它动物的同种基因克隆,因为人类和动物间在同一基因的核苷酸顺序上存在较高的同源性,因此可利用已鉴定的动物基因作探针来筛选人类基因克隆。对于基因核苷酸序列背景清楚而无法获得克隆探针时,可采用PCR方法扩增某段基因序列,并克隆人合适的质粒载体中,即可得到自己的探针。这种方法十分简便,无论基因组DNA探针还是cDNA探针都可以容易地获得,而且,可以建立PCR的基因检测方法,与探针杂交方法可作对比,可谓一举两得。
(二)探针的标记方法
在选择探针类型的同时,还需要选择标记方法。探针的标记方法很多,选择什么标记方法主要视个人的习惯和可利用条件而定。但在选择标记方法时,还应考虑实验的要求,如灵敏度和显示方法等。一般认为放射性探针比非放射性探针的灵敏度高。放射性探针的实际灵敏度不依赖于所采用的标记方法,如随机引物延伸法往往得到比缺口平移法更高的比活性。在检测单拷贝基因序列时,应选用标记效率高、显示灵敏的探针标记方法。在对灵敏要求不高时,可采用保存时间长的生物素探针技术和比较稳定的碱性磷酸酶显示系统。
(三)探针的浓度
总的来说,随探针浓度增加,杂交率也增加。另外,在较窄的范围内,随探针浓度增加,敏感性增加。依我们的经验,要获得较满意的敏感性,膜杂交中32P标记探针与非放射性标记探针的用量分别为5~10ng/ml和25~1000ng/ml,而原位杂交中,无论应用何种标记探针,其用量均为0.5~5.0μg/ml。探针的任何内在物理特性均不影响其使用浓度,但受不同类型标记物的固相支持物的非特异结合特性的影响。
(四)杂交率
传统杂交率分析主要用于DNA复性研究,在这种情况下,探针和靶链在溶液中的浓度相同。现代杂交实验无论在液相杂交还是固相杂交均在探针过剩的条件下进行,此外,固相杂交中靶序列不在液相,故其浓度不能精确计算。因此,本文不讨论通常用于杂交反应的传统二级速率公式,而叙述一级动力学公式。
在探针过量的条件下,杂交率主要依赖于探针长度(复杂度)和探针浓度。下面列出的公式适用于过剩单链探针对靶序列杂交的情形,双链探针开始时(1~4h),杂交动力学相同,但长时间杂交后,由于探针本身的复性,可用于杂交的探针浓度会逐渐降低。公式(1)可用于估计半数探针与固定靶序列杂交所需的时间。
t1/2=ln2/kc
t=保温(杂交)时间(s);k =形成杂交体的速率常数[mol/(Lxntxs)];c =溶液中的探针浓度(mol/L)。速率常数K决定于探针长度(L)、探针复杂度(N)、温度、离子强度、粘度和pH。不含重复序列的探针,l =N。例如,对一个含两个20nt序列的40mer探针而言,l=40,N=20。K与这些变量的关系为:
Kn= 3.5×105K=KnL0.5/N (2)
Kn是缔结常数,Kn =3.5×105。Na+浓度为0.4~1.0mol/L, Ph5~9和杂交温度低于探针-靶序列杂交体Tm值2.5℃时,公式(1)和(2)可合并为(3),用于计算半数探针与靶序列的杂交率(以秒计)。
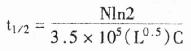
对一个长500个碱基的探针而言,此值为:
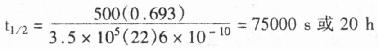
长500个碱基的探针杂交时间很长(20h),应用短探针和使用杂交促进剂有其优越性。由于实际应用的探针长度变化较大(对>1kb的探针,因扩散与粘度效应不可能使因素L得到合适的补偿)。另外,固靶序列也不可能都用于杂交,所以,由公式预计的随探针长度增加的杂交率不一定总是正确的。
(五)杂交最适温度
杂交技术最重要的因素之一是选择最适的杂交反应温度。若反应温度低于Tm 10~15℃,碱基顺序高度同源的互补链可形成稳定的双链,错配对减少。若反应温度再低(Tm-30℃),虽然互补链之间也可形成稳定的双链,但互补碱基配对减少,错配对增多、氢键结合的更弱。如两个同源性在50%左右或更低些的DNA,调整杂交温度可使它们之间的杂交率变化10倍,因此在实验前必须首先确定杂交温度。通常有三种温度可供试验,即最适复性温度、苛刻复性温度及非苛刻复性温度。温度的选择及温度对杂交的影响见表18-3。最适复性温度(Optimunm renaturationtemperature, TOR):Tor =Tm –25℃
苛刻复性温度:Ts = Tm – (10或15℃)
非苛刻复性温度:Tns =Tm – (30或35℃)
在2×SSC反应液中,可以根据下列公式计算最适复性温度:TOr =0.51 (G+C%)+47℃。
表18-4 DNA—DNA杂交温度的选择范围(2×SSC)
| DNA中G+C mol% | 杂交反应温度(℃) | ||
| TOR | Ts | Tns | |
| 30 | 62.3 | 73.3 | 52.3 |
| 35 | 64.9 | 74.9 | 54.9 |
| 40 | 67.4 | 77.4 | 57.4 |
| 45 | 70.0 | 80.0 | 60.0 |
| 50 | 72.5 | 82.5 | 62.5 |
| 55 | 75.1 | 85.1 | 65.1 |
| 60 | 77.6 | 87.6 | 67.6 |
| 65 | 80.2 | 90.2 | 70.2 |
| 70 | 82.7 | 92.2 | 72.7 |
| 75 | 85.3 | 95.3 | 75.3 |
可以看出DNA复性和DNa–RNA, DNA-DNA杂交通常要在高温反应条件下进行,其反应的最大速度是在低于Tm值约25℃。然而对于那些反应时间需要延长,或对生物活性必须保护的复杂生物的核酸研究(如哺乳动物),核酸长时间处于高温下很显然是不利的。这会引起核酸链的断裂、胶嘌呤的作用,结合到膜上的DNA脱落也会增多。这个问题可以通过使用高浓度盐溶液(如6.2mol/l NaCl),或使用某些有机溶剂的水溶液降低反应温度来解决。常使用的有机溶剂有两类,甲酰胺和二甲亚砜(DMSO)。在杂交液中加入30%二甲亚砜可使T2噬菌体DNA的Tm值比原先降低14℃,而使用酰胺甚至可使DNA在室温下变性和复性。Mc-Conaughy等发现,反应液中每增加1%的甲酰胺浓度,Tm值可降低0.72℃。
现在认为,适当选择甲酰胺和盐水浓度及合适的反应温度,可使DNA复性和DNA-RNA杂交获得高特异性和更快的反应速度。
(六)杂交的严格性
影响杂交体稳定性的因素决定着杂交条件的严格性。一般认为在低于杂交体Tm值25℃时杂交最佳,所以首先要根据公式(4)计算杂交体Tm 值。由此式可见,通过调节 盐浓度、甲酰胺浓度和杂交温度来控制所需的严格性。对用20个碱基以上的探针做DNA:DNA杂交的Tm值计算如下:
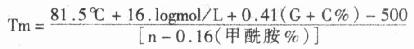
n =杂交体中最短链的长度,因此,对一个G+C为42%的500个碱基探针于5×SSC(0.75mol/l Na+)和50%甲酰胺杂交的Tm 值为:
T=81.5 +(-2.07)+ 17.22 –1 –(30.5)=65℃
T杂交 =65℃–25℃=40℃
影响TM值的其它因素:
(1)对克隆或合成探针而言,同源性每下降1%,Tm值就降低1.5℃,15~50个碱基的寡核苷酸探针的这种作用更明显。
(2)RNA:DNA杂交体的Tm值较同样的DNA:DNA杂交体的高10~15℃。
(3)RNA:RNA杂交体的Tm值较同样的DNA:DNA杂交体的高20~25℃。
显然,当用RNA为靶序列时,要使用甲酰胺来降低Tm 值以保证合适的杂交温度。当以克隆的探针进行膜杂交时,在最后的漂洗步骤中应达到最严格的条件。对一个500个碱基探针而言,典型最终漂洗条件点0.1×SSC(0.015mol/l Na+),55℃。代入公式(4)可得:
Tm =81.5 (-30.3) +17.22 –1-0 =67℃
67℃-55℃=12℃
因此,较Tm低12℃的漂洗条件比Tm 低25℃的杂交相比条件更严格了。
对寡核苷核探针而言,杂交温度往往低于Tm5℃,因此,对一个G+C为50%的30nt寡核苷酸探针来说,Tm 值为:
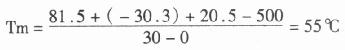
T杂交=55℃-5℃=50℃
下面一个经典的公式适用于14-20个碱基的寡核苷酸探针:
Tm =4℃(g + C) +2℃(a + T)
在实际应用中,寡核苷酸探针的最佳杂交温度必须精确确定。最方便的一种方法是制备一张含不同稀释度靶DNA和非特异靶DNA(如鱼精或大肠杆菌DNA)的膜。在不同温度下使膜与探针杂交,特异靶序列结合探针信号很强,而非特异靶序列与探针无任何反应的温度就是最适温度,在某些条件下,可用二甲亚砜(DMSO)代替甲酰胺来降低Tm值。
用一个以上的探针的(如夹心杂交)杂交系统中,估计Tm值更加复杂。可用上述公式估计每一探针的Tm 值。然后求其均值作为杂交温度。
(七)杂交反应时间
在条件都得到满足的情况下,杂交的成败就取决于保温时间。时间短了,杂交反应不完成;时间长了也无益,会引起非特异结合增多。一般杂交反应要进行20h左右。1966年Britten和Kohne推荐用Cot =值来计算杂交反应时间。Cot 值实际上是杂交液中单链起始浓度(Co)和反应时间(t)的乘积。实验表明Cot =100时,杂交反应基本完成。Cot=0,基本上没有 杂交。例如在液相杂交中未标记的DNa 400μg/ml(按单股DNA每微克 紫外吸收值为0.024计算,总的吸收值为9.6),如果反应时间为21h,那么对于未标记的DNA来说,Cot =9.6/21 =100.8, 杂交完成了。对标记Dn A(浓度为0.1μg/ml)来说Cot值为0.05,这就充分排除了标记DNA的自我复性。
(八)杂交促进剂
惰性多聚体可用来促进250个碱基以上的探针的杂交率。对单链探针可增加3倍,而对双链探针、随机剪切或随机引物标记的探针可增加高达100倍。而短探针不需用促进剂,因其复杂度低和分子量小,短探针本身的杂交率就高。
硫酸葡聚糖是一种广泛用于较长双链探针杂交的促进剂。这是一种多聚胺,平均分子量为500000。另一种常见的促进剂是聚乙二醇(PEG),PEG分子量小(6000~8000)、粘度低、价格低廉,但它不能完成取代硫酸葡聚糖。在某些条件下5%~10%硫酸葡聚糖效果较好,若用5%~10%PEG则可产生很高的本底。因此,使用促进剂时有必要优化条件。另一种多聚体促进剂是聚丙烯酸,用其钠盐,浓度为2%~4%。与硫酸葡聚糖相比,其优点是价格低廉,粘度低(MW=90000)。
小分子化学试剂酚和硫氰酸胍也能促进杂交,它们可能是通过增加水的疏水性和降低双链和单链DNA间的能量差异而发挥作用。酚作为杂交促进剂,只能在低DNA浓度的液相杂交中观察到,该方法曾被称为酚乳化复性技术,该法不能用于固相杂交,因酚可引起核酸与膜的非特异吸附作用,即使在液相杂交中的应用也是有限的。而硫氰酸胍可通过降低双链DNA的Tm值而起作用。此外,该分子还可以促进RNA的杂交,有裂解细胞而抑制RNase的作用。总之,硫酸葡聚糖和聚乙二醇因能用于固相杂交是目前最常用的杂交促进剂。
-
《实用免疫细胞与核酸》 中的相关章节:
……
第八节 汗腺及汗腺肿瘤的免疫细胞化学特点
参考文献
第十八章 核酸分子杂交技术概述
第一节 核酸的分子结构
第二节 DNA的变性与复性
第三节 分子杂交(当前页)
第四节 石蜡包埋组织的DNA提取及其应用
参考文献
第十九章 核酸(基因)分子探针
第一节 概述
……