第三节 结果分析
ICC染色结果判断与其它组织化学相似,应在熟悉所应用方法、抗体的优点和局限性的基础上,避免主观意识,进行客观判断。一般认为在严格操作、控制染色的条件,选择特异性抗体等条件下,所得结果是阳性时才有积极意义。而阴性时,不一定意味着该物质或抗原不存在,即不能排除实验过程所致的抗原丢失或抗体选择不当等引起人工假象。另外根据ICC染色强弱做半定量分析时,必须是同时固定、相同的组织块、相邻/同一切片,在严格控制抗体用量和显色时间等条件下,进行图象测定,否则无法相互比较。镜检时,首先从对照标本开始,判断固定是否合适、非特异性着色强弱等再从低倍至高倍顺序观察实验标本,预期阳性部位是否被染色,不该含此类物质的部位是否阴性等。一般认为,切片边缘的较强染色,属于非特异性着色,所以应避免作为阳性结果的依据。同时应结合对照实验、鉴别假阳性,以便做出正确判断。
一、对照实验
1.常用的吸收实验分固相吸收和液相吸收两种(见本书第一章 ),对于不能形成沉淀,难以用离心沉降法分离的一些小分子多肽类抗原,以固相吸收为佳。一般市售抗体均经特异性检测,所以应用购买抗体时可省略此步。
2.交叉实验 我们知道,引起机体免疫应答反应的并非是免疫原整个分子,而是其中的一部份—抗原决定簇。每个抗原可能有不同的抗原决定簇,不同的抗原亦可能有类似的抗原决定簇,因此一种抗血清可能与几种抗原结合。所以同时最好亦用结构相近的抗原做吸收实验,以避免抗原间的交叉反应。
3.替代实验 用制备第一抗体相同种属的正常血清(1/10或相同IgG浓度)替代第一抗体或用第二抗体相同种属的正常血清替代酶标抗体/桥抗体或省略其中任何一种免疫试剂或酶等,以PBS代替之,分别孵育切片,结果均应为阴性。
4.置换实验 应用无关的特异性抗体代替第一抗体,孵育切片,结果应阴性。如果同时进行几种特异性抗体的ICC染色时,彼此之间即为此类对照。例如,无关的数种抗体,均在相同部位出现类似阳性结果时,非特异性着色的可能性较大,应慎重判断。
5.阳性对照 不具有ICC染色经验者,从事此项工作时,最好同时染色已知阳性标本,以排除操作过程失误所致的染色阴性。阳性标本切片最好冰冻保存备用。
另外,在观察新的组织抗原时,最好同时比较不同的固定的组织标本、冰冻切处及石蜡切片的ICC染色,选择最佳条件,以期得到良好的实验结果。
二、假阳性及其处理
组织成分与各种染色试剂及抗血清之间的非特异性结合称假阳性,其主要原因和处理方法如下:
1.组织细胞内色素 与DAB沉淀物颜色类似的色素,例如黑质内的神经黑色素,不易与反应产物区别开来。可用其它电子供体或免疫荧光技术鉴别之,亦可改用ALP代替HRP,进行染色。
2.假过氧化物酶活性RBC内的血红素辅基有类过氧化物酶活性,当组织内存在红细胞时,即使不加过氧化酶,亦可出现阳性染色。用甲醇-0.3%H2O2孵育标本15~20min(室温),能抑制这种假阳性。甲醇可以使血红素蛋白中的(亚铁)血红素游离,后者被H2O2破坏,从而抑制类过氧化物酶的活性。一般认为,RBC的染色容易同其它组织细胞区别,且动物实验还可通过灌注冲洗组织内的RBC,所以此步往往被省略。
3.内源性过氧化物酶活性粒细胞、巨噬细胞等存在内源性过氧化物酶,能够与DAB-H2O2反应,导致假阳性,所以含此类细胞较丰富的脾脏、肝脏、骨髓等组织,ICC染色时,最好做内源性酶阻断。适当的固定、经酸酒精孵育15~20min,或1%乙酸-甲醇硝基铁氰化物处理,冰冻切片可用苯肼孵育15~20min,均能不同程度地抑制内源性酶的活性。近年Li(1987)报告,应用0.1%NaN3 0.3%-- H2O2孵10~15min(室温)能较好地抑制内源性过氧化物酶的活性,冰冻切片效果尤佳。嗜酸性粒细胞内源性过氧化物酶活性较强,上述各种处理后,仍残留部分活性,此种情况,在DAB-H2O2显色液中加入终浓度为0.05NaN3,基本上可达到完全阻断的作用。但是,各种封闭内源性(假)过氧化物酶方法均不同程度地破坏组织的抗原性,所以在不影响反应结果判断或能够同内源性酶的反应所致的假阳性区别时,尽量避免此类处理或改用ALP代替HRP进行ICC染色,也可以在用第一抗体与抗原反应结合后,再进行消除内源酶的处理。
4.游离醛基醛类固定的组织切片上,可能存在些游离醛基,后者能与蛋白质(含IgG)间非特异性结合,导致假阳性,用白蛋白或封闭性阻断等预先孵育切片,可封闭之。
5.疏水键和离子键免疫球蛋白可通过疏水键或离子键与组织中的碱性蛋白或Fc受体(冰冻切片Fc受体保存尤佳)非特异性结合。用正常血清(制备第二抗体种属的血清为首选),于第一抗体前孵育切片,可消除之。“4”和“5”重叠应用,更有利于降低背景染色。
6.天然抗体及不纯抗体 天然抗体是指因动物自然感染等原因血清中存在的部分抗体:不纯抗体是指在制备血清时,所用的抗原不纯,获得的抗体含有杂质抗体。当天然抗体或不纯抗体与组织成分结合时,可引起非特异性染色。上述二者的含量均较低,增加第一抗体的稀释度,可以降低其非特异性染色。
7.载体蛋白抗体 制备小分子多肽(分子量小于4kD)的抗体时,需借助载体蛋白,使小分子多肽获得免疫原性,刺激动物产生特异性抗体。因载体本身具有抗原性,故动物同时也产生抗载体蛋白抗体,与组织蛋白结合后,引起背景染色。用固相吸收技术,能将载体蛋白抗体除去。一般市售抗体,均经特异性检测,所以“6”和“7”可不必考虑。
三、抗体有关事项
1.血清特异性检测 为了发现新的物质或其它方法未能显示的物质、而又无相应抗体可购买时,往往需要自己制备抗血清。制备时应检测抗血清的特异性。常用的方法有:
(1)放射免疫分析(RIA)、免疫扩散或电泳及ICC法:在制备抗血清的过程中 ,用RIA和免疫电泳等方法检测抗血清的效价是不可少的。一般认为,RIA和免疫电泳的最佳稀释度较高。ICC染色时,应从其1%的稀释度试用之较合适。在制备ICC用抗血清时,最好在应用RIA和免疫电泳法的同时结合ICC染色,以鉴定抗血清的质量(制备单克隆抗体时,仅用ICC染色筛选特异克隆即可)。因为免疫过程中,各个时期抗血清效价不同的,例如给动物免疫催产素,7周时血清ICC染色较好,RIA不佳;在10~12周期间,RIA效价升高,但ICC染色较差。因此制备ICC用抗血清时,应在ICC染色效价最佳时,收集抗血清。
(2)系列稀释第一抗体法:在一定稀释度时,抗体的特异性结合最强;继续增加抗体的稀释度,特异性反应将随之减弱至消失。因此采用系列稀释第一抗体的方法,能够验证抗血清的特异性。
2.抗体的选择 原则上应选择在较高稀释度时染色较佳而背景较低、结果稳定、重复再现良好的抗体。目前供ICC研究用的抗种类繁多,制造商如林,不同的厂家的相同抗体,其价格、包装及抗体的最佳工作浓度,差异较大。所以选购时,应多听取有经验者的建议,参考文献报告,并且自己应多查找不同厂家的抗体商品目录,恰当地选购自己所需的抗体。
3.抗体最佳稀释度的检测 抗原抗体反应要求一定比例,过量或不足,均不能达到预期的结果,所以ICC染色时,应进行抗体最佳稀释度的检测。市售抗体所附说明书均标有工作液浓度,但实际上,厂商常常给较低的稀释倍数,因此应用时,可将所给工作液浓度稀释数倍至数百倍再进行系列染色,选择其中特异性染色最强、背景着色最低的释释度作日常ICC染色浓度。在抗体来源不明、又无任何可供参考依据时,则可从原液至数倍稀释试用。另外,酶标抗体/连结抗体和PAP复合物等也需要确定最佳工作液浓度。一般认为酶标抗体可用稍离浓度,例如HRP标记抗体为1:80~160、ALP标记抗体为1:50~100染色较理想。PAP法染色时,连结抗体稀释1:50、PAP复合物用1:50~200染色较合适。
4.抗体的保存 为确保ICC染色结果稳定、再现性良好,应避免抗体反复冻融所致的效价降低。第一抗体分装、冷冻保存为佳,其最小包装可为每次用量或2周内用量。例如某抗体的工作液浓度1:1000~2000,每次染色需抗体量为1~4ml时,则所需原液为1~2μl。将原液分装成几微升难度较大,所以先将原液稀释为1:10~100,每支离心管内10~100μl保存,应用前稀释至工作液浓度。后者不宜冰冻,4℃可保存2~3周,原液和1:10~100的抗体在-80℃可保存数年而染色结果不变。单克隆抗体为培养液上清或腹水时,应4℃保存,应早应用。酶标抗体和PAP复合物原液4℃保存1年左右,免疫活性和酶活性不发生改变,大量制备的酶标抗体/PAP复合物最好分装后于-80℃或-20℃保存。所分装的抗体,应注明名称,稀释度、量及日期等,同时应在笔记本详细记录。ICC研究所用的任何抗体及酶,均应严格记录,妥善管理,才能保证实验成功。
四、单克隆抗体
在单克隆抗体问世前,ICC染色中通常所用的抗血清均为多克隆抗体,即抗血清含有多少B淋巴细胞株所分泌的抗体,这些抗体的性质不完全相同,不同的抗血清之间可能有交叉反应,使ICC染色受到一定限制。近年,单克隆抗体的引入,特别是市售单克隆抗体和种类和数量的迅猛发展,及各实验者比较容易制备自己所需的单克隆抗体,为ICC染色在特殊抗原定位、生物活性检测、肿瘤标记识别中,开辟了更广阔的前景。
1.单克隆抗体的制备(Oi,TV, 1980)(详见第一章 )。
2.单克隆抗体的特点
(1)酶标抗体:自己制备或市售商的单克隆抗体,绝大部分为小鼠IgG、Kappa型,所以酶标抗体选择抗小鼠IgG的多价抗体,进行ICC染色比较稳妥。
(2)特异性:专一性强:单克隆抗体是由同一细胞株分泌的,性质均一,且有相同的亲合力,识别同一抗原决定簇。这在研究某些类似物质的局部定位、分型、生物活性检测及肿瘤诊断等方面有重要意义。但同时也应注意,不同抗原的相同抗原决定簇有被识别的可能,所以应结合其它方法,判断其结果。
(3)不需纯化抗原:多克隆抗血清在制备时,要求抗原相当纯。而制备单克隆抗体时,不需纯化抗原。一些不能纯化的组织(游离)细胞可直接免疫,经克隆化,筛选所需细胞株,避免了纯化抗原的麻烦,这在研究人类各种疾病等有重要价值。
(4)工作液浓度:不同的单克隆抗体效价各异,所以ICC染色时需检测最佳稀释倍数,大量培养纯化的抗体可用更高的稀释倍数。
(5)切片选择:单克隆抗体仅识别抗原物质的某一抗原决定簇,所以以新鲜组织的冰冻切片为首选。因为在固定过程中,可能使抗原物质发生某些改变,致使其与单克隆抗体反应的抗原决定簇丢失,故拟用石蜡切片固定组织冰冻切片。ICC染色时,在制备单克隆抗体过程中,应该用同样标本和方法筛选所需细胞株,才能确保染色成功。
(6)特异性检测:单克隆 抗体的特异性强,性质均一,没有必要进行RIA分析和吸收实验等。自己制备的单克隆抗体,其特异性检测最佳方法为相同组织提取物质进行免疫电泳,确定抗原的分子量等。
(7)发现新物质:在制备肿瘤或其它组织细胞单克隆抗体时,往往有各种各样的抗原特异性杂交瘤细胞株产生,在筛选过程中,能够发现一些新的杂交瘤株,经培养制备相应的抗体,用于一些新领域的研究。
五、增加染色强度方法
通常染色、着色较弱时,应想办法改进标本的处理的抗原的保存,提高抗体的穿透力,再重新染色。但有时组织本身抗原含量较少或标本难得(如手术材料),可尝试下述方法以提高染色强度,确保染色成功。
1.重复显色一般认为,对ALP标记抗体,延长显色时间其反应可增强。但在同一染色液中延长显色时间,往往容易产生沉淀,出现终产物弥散现象。所以重新配制显色液继续呈色,第二孵育时间可缩短至4~5min,能提高部分染色强度。
HRP标记时,重复呈色无明显增强效应。通常在显色液中加入0.01mol/l Imidazole 或改用酸性缓冲液(pH5.5~6.0),可提高染色强度;亦可在DAB反应后,1%OSO4浸泡固定5~15min,继之0.4%亚铁氰化钾/0.1N HCl液处理5min,DAB终产物呈黑色,与背景的对比度较佳。另外,在间接法显色较弱时,亦可试用PAP法、ABC法等,探索较合适的染色方法。
2.重复第一抗体在漂洗过程中,结合力弱的抗体易离解丢失,重复应用第一抗体有利于抗体与组织抗原结合,增加抗体数量,提高染色强度(Noorden 1983)。切片经第一抗体孵育后,漂洗,再孵育第一抗体(此时第一抗体可稀释较原工作浓度1至数倍)2~4h,然后经酶标抗体孵育,呈色观察同前。所用抗体为多克隆血清时,提高第一抗体的稀释度,重复孵育2~3次,可得到一定效果。单克隆抗体,经第一抗体—酶标抗体—第一抗体—酶标抗体,也能增加染色强度。
3.双桥PAP法(Vacca 1982) 基本操作与单桥法相似,所不同的是切片经单桥PAP复合物孵育后,漂洗,再孵育桥抗体和PAP复合物(均可稀释1倍),即切片经两次桥抗体、两次PAP孵育—双桥法(Double bridged technique)。据报告,第一抗体用较高稀释度(例单桥法两倍),也能获得与双桥法相近的染色效果。
理论上讲,双桥法是ICC染色中较为敏感的方法,它较单桥法灵敏20~50倍,能够增加抗原的显示数量(25%)和反应终产物的大小。这在研究胚胎发育过程中一些抗原含量较低的组织时,具有一定的应用价值。双桥法可能是通过下列途径提高其敏感性的:①重复的桥抗体与PAP复合物中的抗HRP抗体的未饱和抗原位置结合,再连结另外的PAP复合物,在抗原部位抗体间彼此结合形成较大的抗原抗体复合物,具有多个酶分子(图4-9A),使反应增强。这可能是双桥法敏感性增高的主要机制;②重复的桥抗体与第一抗体未饱和的抗原位置结合,使第一抗体上结合较多的桥抗体及PAP复合物(图4-9B)。但PAP复合物较大,应设法提高其穿透性,达到增加染色强度的目的。
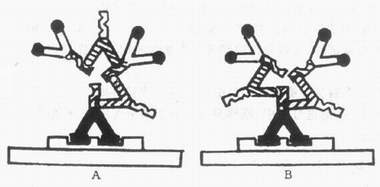
图4-9 双桥PAP法的两种放大原理
4.半抗原夹层法(Hapten Sandwich Method) 首先用半抗原(FITC等)标记的第一抗体与组织抗原结合,继之用HRP(或ALP)标记的抗FITC抗体与组织抗原结合的FITC的反应,呈色后观察抗原存在部位。FITC为一种荧光色素,荧光显微镜下呈亮绿色荧光,所以也可以同时观察免疫荧光染色结果。FITC特异荧光褪色后,其抗原性仍不丢失,从这种角度讲,荧光抗体法的切片亦能半永久保存。该法较一般间接法敏感性高,最大优点是不管第一抗体来自何种属,只要与FITC连结,均可被同一酶标记的抗FITC抗体识别。避免了准备不同种属的酶标抗体的麻烦,而且FITC标记抗体技术成熟、稳定,商品种类多,容易购买,实验者不妨一试。
-
《实用免疫细胞与核酸》 中的相关章节:
……
第五节 非特异性染色的消除方法
参考文献
第四章 免疫酶细胞化学
第一节 固定和切片
第二节 染色方法
第三节 结果分析(当前页)
第四节 ICC的几种特殊应用
参考文献
第五章 免疫金银及铁标记技术
第一节 免疫金技术发展史
……