谷氨酰胺缺乏对急性早幼粒白血病原代细胞生长和分化的影响
中国病理生理杂志 2000年第10期第16卷 论 著
作者:梁实
单位:香港驻军医院, 深圳518048
关键词:谷氨酰胺;白血病;早幼粒细胞;急性;细胞分化
[摘 要] 目的:了解谷氨酰胺(Gln)缺乏对急性早幼粒白血病(APL)原代细胞生长和分化的影响。方法:从18例未经治疗的APL病人外周血中提取APL原代细胞,在无Gln的RPMI 1640培养液中补加10%胎牛血清,以活细胞密度5×108/L接种细胞,在37 ℃, 5% CO2和饱和湿度下培养4 d,计数活细胞,并收集细胞行Wright-Giemsa、DNA、POX、NAE及NaF抑制试验、墨汁吞噬试验和NBT还原试验等细胞化学染色,于油镜下观察。结果:经4 d培养,其活细胞密度为起始活细胞密度的(54.28±4.28)%,而对照组为(108.56±12.27)%(P<0.01);成熟分叶核粒细胞和杆状粒细胞比例显著高于对照组(P<0.01)。结论:缺乏Gln可使APL原代细胞生长受到抑制,并可使之向成熟粒细胞方向分化。
[中图分类号] R733.71 [文献标识码] A
[文章编号] 1000-4718(2000)10-0909-03
Effect of glutamine deprivation on growth and
differentiation of primary APL cells
LIANG Shi
(Hong Kong Garrison Hospital of PLA, Shenzhen 518048,China)
[Abstract] AIM:To investigate the effect of Gln deprivation on growth and differentiation of primary APL cells. METHODS: The primary APL cells were collected from 18 cases of APL patients' periphery blood, the patients had not been treated. The cells were incubated in RPMI 1640 without or with different contents of glutamine and with 10% fetal calf sera, at 37℃,5% CO2 and saturation humidity for 4 days.The initial living cell density was 5×108/L. After 4 days incubation,the cells were counted,collected, smeard and stained with Wright-Giemsa, DNA, POX, NAE and NaF inhibition,gulping ink and NBT etc. cytochemical technology. The stained cells were investigated under oil immersion lens. RESULTS: The living cell density became (54.28±4.28)% of the initial in glutamine deprivation group, but the living cell density in control with 4 mmol/L Gln was (108.56±12.27 )% of the initial (P<0.01) after 4 days incubation. The cells differentiated into mature granulocytes in glutamine deprivation group. CONCLUSION: Deprivation of glutamine inhibited primary APL cell growth and induced cell differentiation toward mature granulocyte.
[MeSH] Glutamine; Leukemia, promyelocytic, acute; Cell differentiation
氨基酸(amino acid,AA)对白血病细胞生长和分化有重要影响,并且白血病细胞与正常细胞AA代谢有差异[1,2]。在另文[2-7]中作者已对U937、K562细胞株氨基酸代谢的特点及干扰AA代谢对其生长分化的影响进行了一些报告。为进一步探索缺乏谷氨酰胺对病人急性早幼粒白血病原代细胞生长和分化的影响,进行了本研究。
材 料 和 方 法
一、材料
(一)培养液 无谷氨酰胺的Roswell Park Memorial Institute (RPMI) 1640培养基干粉(GIBCO),用三蒸水按说明书配制,每升加青霉素和链霉素各10万单位,用0.22 μm微孔滤膜正压过滤,补加10%灭活胎牛血清(军事医学科学院提供)。对照组按实验要求补加不同浓度的谷氨酰胺(glutamine,Gln,华美)。
(二)急性早幼粒白血病(acute promyelocyte leukemia,APL)原代细胞 18例APL患者为1992年8月至1996年12月期间在广州军区广州总医院住院治疗者,用淋巴细胞分离液(上海试剂二厂)分别提取18例未经治疗的APL病人外周血单个核细胞。
二、方法
(一) 培养条件 37 ℃,5% CO2,饱和湿度。
(二) 活细胞计数 每9滴细胞悬液加1滴4%台盼蓝溶液,3 min后计数拒染细胞。
(三) 对细胞生长情况的观察 分别在实验组和对照组培养液中接种细胞,起始活细胞密度为5×108 /L,于第4 d计数活细胞密度。
(四) 对细胞分化的鉴定与观察 于培养第4 d收集细胞,并制片、干燥、染色。染色及形态学观察:Wright-Giemsa、peroxidase (POX)、(α-naphthyl butyrate esterase (NAE)及sodium floride (NaF)抑制试验、DNA染色和墨汁吞噬试验均按常规方法进行。 nitroblue tetrazolium(NBT)还原试验染色按文献[8]方法进行。于油镜下行细胞形态学观察。
结 果
在缺乏Gln的条件下培养18例病人的APL原代细胞4 d, 发现其活细胞密度为起始活细胞密度的(54.28±4.28)%,明显低于对照组(Gln, 4 mmol/L)(108.56±12.27)% (P<0.01, 见表1),说明其生长明显受到抑制。在不同Gln浓度下培养APL原代细胞4 d(重复3次),显示出活细胞密度与Gln浓度的量效关系,经直线相关分析证实二者呈正相关(r=0.72, 0.01<P<0.05)。当Gln 浓度达0.5 mmol/L时,细胞就能较好地维持存活状态,其活细胞密度为起始活细胞密度的93.80%。
表1 谷氨酰胺缺乏4天对APL原代细胞生长和分化的影响
Tab 1 The effect of 4 days glutamine deprivation on growth and differentiation of primary APL cells (%. 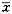 +s. n=18)
+s. n=18)
| Gln |
Living cell ratio |
Promyelocyte |
Metamyelocyte |
Stab cell |
Lobocyte |
| (mmol/L) |
to the initial |
& myelocyte |
| 0 |
54.28±4.28* |
9.72±2.54* |
13.67±2.33* |
16.78±2.88* |
60.39±4.72* |
| 4 (Control) |
108.56±12.27 |
91.94±2.15 |
3.67±1.33 |
2.28±1.18 |
2.11±1.23 |
*P<0.01 vs control; the initial living cell density was 5×108/L. 经Wright-Giemsa染色涂片,于油镜下观察发现,APL原代细胞呈典型早幼粒细胞形态,圆或椭圆形,胞浆中布满粗大噬天青颗粒,胞核圆或椭圆,可见核仁。补加Gln 4 mmol/L的对照组经4 d培养,除胞浆颗粒略有减少外,形态上与培养起始时比较无明显改变。当所补加的Gln浓度减至0.125 mmol/L时, 可观察到细胞向成熟粒细胞方向分化的现象。当补加的Gln浓度为0时,培养4 d,细胞浆内粗大噬天青颗粒消失,代之以散在的细小粉红色颗粒。仍有6-15%的细胞核呈圆形,核浆比例>3/4,难以区分是早幼还是中幼粒细胞,故将这两类细胞合并在一起统计。大部分细胞分化为分叶核粒细胞和杆状核粒细胞(见表1),但其细胞核形态与人正常成熟粒细胞又有所不同,其扭曲盘旋,核突增多。DNA染色显示核型亦以分叶核及杆状核为主。POX染色+ + + +10例,+ + +7例,+ +1例。NAE染色+ +3例,+10例,阴性5例;NaF抑制试验除1例+(此例NAE+ +)外,其余均为阴性。墨汁吞噬阳性率为(68.87±5.47)%, 明显高于对照组(17.60±2.57)%(P<0.01)。NBT还原阳性率(86.67±2.52)%,明显高于对照组(9.56±1.25)% (P<0.01)。说明细胞向成熟分化了。
讨 论
通过干扰人体非必需AA代谢治疗白血病的研究日益引起人们的重视,特别是L-天门冬酰胺酶已经用于临床治疗急性淋巴细胞白血病,取得了肯定疗效,并且没有明显抑制骨髓正常造血的副作用,但其对非淋巴白血病疗效差。
作者观察到非淋巴细胞白血病U937和K562细胞株对精氨酸和谷氨酰胺消耗很大[2],精氨酸酶或剥夺谷氨酰胺对这两种细胞的生长有明显抑制作用[3,4],并且有诱导分化作用[6,7]。对不同Gln浓度下U937、K562细胞生长的情况在另文中[3]已报告,当Gln浓度达1 mmol/L时即可较好地生长,当Gln浓度<0.25mmol/L时可将这两种白血病细胞生长抑制2-3倍,而缺乏Gln对正常人PHA刺激淋巴细胞生长仅抑制0.18倍。本课题观察到了缺乏Gln对APL原代细胞的抑制作用,经4 d培养其活细胞密度为起始密度的(54.28±4.28)%, 而补加4mmol/L Gln的对照组活细胞密度为起始时的(108.56±12.27)%,其生长仅抑制了1倍,抑制率明显较U937、K562细胞为低,这可能与原代细胞中处于G0期的细胞较多,细胞株中处于G0期的细胞较少有关。实验中不能排除补加10%胎牛血清带入了微量Gln,文献[9] 报告10%胎牛血清中Gln含量为88 μmol/L。
Pilzer等[10]报告急性早幼粒白血病HL-60细胞在缺乏精氨酸等单一AA条件下,向成熟粒细胞方向分化;Nichols和Weinberg[11]报告HL-60细胞在缺乏精氨酸条件下,向成熟单核细胞方向分化。其研究观察对象均为细胞株,尽管均来自人白血病细胞,但与原代细胞有差异。本文对18例病人的APL原代细胞进行了研究,观察到缺乏Gln使细胞向成熟粒细胞方向分化。实验中墨汁吞噬试验和NBT还原试验阳性率明显高于对照组,进一步证实了细胞向成熟分化。POX染色强阳性,NAE染色弱阳性或阴性,并且不被氟化钠抑制,进一步证实了细胞分化方向为粒系。
缺乏某些AA可以使白血病细胞生长及蛋白质合成受抑,是否这是导致细胞向成熟分化的直接原因?似乎是否定的。Pilzer等[10]发现,放线菌酮、嘌呤霉素、吐根碱等蛋白合成抑制剂及葡萄糖缺乏均可使HL-60细胞生长和蛋白质合成受抑,但均不能使之向成熟分化。组氨酚(histidinol)是组氨酸tRNA合成酶抑制剂,可导致非氨酰化(无负载)tRNA-His积聚,在培养基中加入1×10-8 mol/L组氨酚即可使HL-60细胞向成熟分化。无负载tRNA积聚可能与诱导分化过程中基因表达调节引起的mRNA识别的变化有关。在缺乏Gln时,其相应无负载tRNA同样会增多,可能会引起类似的效应。白血病细胞的分化还与AA通道的改变有关[12],在缺乏某种AA时,细胞膜上相应的AA通道开放会增多,并伴有mRNA和蛋白质合成的变化[13],说明与基因表达发生了变化有关。经缺乏Gln诱导APL原代细胞所分化来的分叶核粒细胞,在形态上与人体内正常分叶核粒细胞有一些差异,其细胞核扭曲盘旋、核突增多,对此作者在另文[5]中进行了进一步讨论。
Tel:0755-4481567
[参 考 文 献]
[1] 梁 实.蛋白质氨基酸代谢与白血病[J].国外医学输血及血液学分册, 1992,15(3):145-146.
[2] 梁 实. 对U937、K562白血病细胞氨基酸代谢的研究[J]. 解放军医学杂志,1995, 20(2):127-128.
[3] 梁 实.谷氨酰胺缺乏对U937、K562细胞生长的抑制[J]. 营养学报, 1994,16(2):155-159.
[4] 梁 实.精氨酸酶对U937、K562细胞生长的抑制[J].中国病理生理杂志, 1994,10(7):776-779.
[5] 梁 实,梁 骞.肿瘤可逆过程中的不可逆性[J].医学与哲学,1993,14(5):15-16.
[6] 梁 实.Arginase和剥夺Gln对K562细胞的诱导分化[J].营养学报, 1995,17(2):147-151.
[7] 梁 实, 郭秀芝.精氨酸酶对急性非淋巴白血病细胞的诱导分化[J].营养学报, 1996,18(2):145-148.
[8] 青木延雄,柴田 昭.血液学研究检查法[M].孙素莲等译. 第1版.北京:科学出版社, 1986. 194-202.
[9] Beebe DP, Faguet GB.Nutritional requirements of human malignant(leukemic) cell lines: implications for adjuvant therapy[J]. Cancer Res, 1987,47(9):2380-2385.
[10] Pilzer RB,Berghe GVD,Bose RE. Induction of HL-60 cell differentiation by starvation for a single essential amino acid but not by protein inhibitor[J]. J Clin Invest, 1987, 29(3):1006-1009.
[11] Nichols KE,Weinberg JB. Essential amino acid deprivation induces monocytic differentiation of the human HL-60 myeloid leukemia cell line[J]. Blood ,1989,73(5):1298-1303.
[12] Vadgama JV, Chan M, Wu JM. Differential expression of amino acid transport system A and ASC during erythroleukemia cell differentiation[J]. Am J Physiol, 1991, 260 (cell physiol.29):C392-397.
[13] Christensen HN. Interorgan amino acid nutrition[J]. Physiol, 1982, 62(4):1193-1202.
[收稿日期] 1999-06-18
[修回日期] 1999-12-30