改良哥伦比亚巧克力培养基分离流感嗜血杆菌
第二军医大学学报1999年第20卷第6期
修清玉 赖国祥 王桂芳 方正 陈吉泉 罗文侗
摘 要 目的:评价自制的改良哥伦比亚巧克力琼脂(ICCA)培养基对流感嗜血杆菌(Hi)的分离效果。方法:将Hi(ATCC49247)接种于ICCA和其他4种Hi培养基上,计算和比较5种培养基中Hi的平均生长指数;用ICCA对878份呼吸道标本进行培养后检测Hi。结果:ICCA培养的Hi平均生长指数为17.79±1.47,明显高于其他4种培养基(P<0.01)。ICCA培养的呼吸道标本中Hi的检出率为23.3%。结论:ICCA是一种较好的Hi选择性培养基,值得推广应用。
关键词:嗜血菌,流感 培养基
流感嗜血杆菌(Haemophilus influenzae,Hi)是引起下呼吸道感染最常见的致病菌之一,其分离培养对临床上早期诊断和正确选用抗生素治疗极为重要。但Hi生长必须具备Ⅴ因子和Ⅹ因子等条件,常规培养阳性率低。我们研制了改良哥伦比亚巧克力琼脂(improved Columbia chocolate dagar,ICCA)培养基,并与文献推荐的4种培养基进行比较,Hi临床应用获得较好效果。
1 材料和方法
1.1 培养基 (1)ICCA:以Columbia琼脂为基础,加2%胰蛋白胨,0.1%酵母浸出膏 ,溶于1 000 ml蒸馏水中,调整pH值至7.4~7.6,高压灭菌15 min后加入5%的脱纤维羊血制 成 平板。(2)血琼脂(blood agar,BA):按常规方法制备。(3)普通巧克力琼脂(common chocola ted agar,CChoc) :按常规方法[1]制备。(4) 改良GCYSB培养基(M GCYSB):按Ren nie等[2]及邓光贵等[3]的方法配制。(5)Miller-Hinton琼脂(MHA):以M - H琼脂(上海试剂供应中心)为基础,分别加入0.5 ml/L血红蛋白及β-NAD(Sigma公司)[4]。β-NAD经滤菌器过滤后加入MHA中,倾注平板。(6)脑心浸液琼脂培养基(brain heart infusion agar,BHIA):按吴丽华等[5]的配方配制。
1.2 菌种及标本来源 菌种:Hi49247由CDC引进。临床标本:(1)收集1994年9月至1997年5月我院门、急诊拟诊为急性上、下呼吸道感染的成人患者448例,冷开水漱口后留取痰标本,镜检中性粒细胞和鳞状上皮细胞之比大于2.5∶1者为合格标本,1h内接种。(2)对同期下呼吸道感染的儿童334例,取咽拭子接种。(3)同期扁桃腺切除术后的扁桃腺组织7例,0.9%的生理盐水清洗后,剪碎,磨成匀浆,取上清1ml接种;鼻窦炎患者22例,取其鼻窦穿刺物即刻接种。临床标本均接种于ICCA培养基。
1.3 生长指数(growth index,GI)测定 参考Anesty法[6],将HiATCC49247用生理盐水配制成0.5麦氏浊度的悬液,含菌数2.3×108个/ml,连续稀释至第8管,取各稀释度菌液0.1ml,分别接种于ICCA,CChoc,MGCYSB,MHA,BIHA5种培养基上,每种培养基接种3块平皿,“L”形棒涂布菌液,置5%CO237℃孵育24h,用JC4-10读数显微镜(40倍,上海浦东物理光学仪器厂,精确度为0.001mm)准确量取菌落直径。GI等于平皿上生长菌落数少于10个的最高稀释指数乘以该平皿上菌落平均直径。如10-4稀释时平皿上生长6个菌落,其平均直径为2.5mm,则GI=4×2.5=10。计算每种培养基的平均GI。
1.4 呼吸道标本Hi分离 取合格痰标本,中心部分划线接种于ICCA培养基上,ICCA的第2区以倒三角形贴上万古霉素(V,30μg)、杆菌肽(B,10IU)、林可霉素(CM,2μg)药敏纸片(上海市卫生防疫站),间距1.5~2.0cm,置5%CO237℃孵育24h,挑取可疑菌落进行鉴定。
1.5 Hi鉴定依据 (1)菌落无色透明或灰白色半透明、湿润、圆形隆起且具特殊反光现象,直径约0.3~0.7mm;(2)显微镜下呈多形的革兰阴性球杆菌;(3)生长需要因子Ⅴ和Ⅹ(卫星试验阳性);(4)血琼脂平皿上不溶血。
1.6 统计学处理 ICCA与其他4种培养基GI的差异比较用t检验。
2 结 果
2.1 Hi在5种培养基上的GI测定 所有培养基在10-6稀释时均见Hi生长,但在10-7稀释时仅见ICCA及MGCYSB有2块平皿、MHA有1块平皿有Hi菌落(表1)。结果显示,ICCA培养基上菌落最大且典型,平均直径为2.67mm,MGCYSB及CChoc培养基上菌落相对较小,在BHIA培养基上最小,平均直径小于1.00mm。经统计学处理,ICCA的GI值明显高于其他4种培养基(P<0.01)。
2.2 对呼吸道标本的Hi分离培养结果 ICCA培养基上痰标本检出Hi96株,检出率为19%(96/505)。咽拭子标本Hi检出率为28.8%(99/344),在该培养基上第2区形成的三角形局部Hi选择性分离培养区内,其他细菌少或无,Hi菌落生长典型,呈透明或灰白半透明,直径约0.3~0.7mm,表面湿润,具有特殊的反光现象,在第1,3,4区则可看见其他细菌生长。切除的扁桃腺标本中Hi检出率为57.1%(4/6),鼻窦炎患者鼻窦穿刺液Hi检出率为27.3%(6/22),总检出率为23.3%(205/878)。
表1 Hi49247在5种培养基上GI检测结果tab 1 GI of ATCC 49247 in the five media
| Medium |
Meansize of
colony(l/mm) |
Mean highest
dilution(log) |
Mean GI
(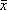 ±s) ±s) |
| ICCA |
2.671 |
6.7 |
17.79±1.47 |
| MGCYSB |
1.498 |
6.7 |
9.83±0.14** |
| BHIA |
0.716 |
6.0 |
4.26±0.48** |
| CChoc |
1.826 |
6.0 |
10.82±0.78** |
| MHA |
1.570 |
6.5 |
10.21±1.12** |
ICCA:Improved Columbia chocolated agar;M GCYSB:Mo-dified GCYSB;CChoc:Common chocolated agar;BHIA:Brain heart infusion agar;MHA:Miller-Hinton agar
**P<0.01 vs ICCA
3 讨 论
流感嗜血杆菌分离培养基的组方至今尚未统一规范,原因为Hi生长需要特殊的条件,要求一定浓度的CO2、因子Ⅴ、Ⅹ及合适的pH值,同时亦易受其他细菌生长的抑制,故分离率不高。近10余年来,国内外学者对此作了有益的探索,在有因子Ⅴ、Ⅹ的培养条件下,Hi易于生长,已经证实金黄色葡萄球菌能利用琼脂及血液合成脱氢酶及类似血红蛋白化合物。因此,临床上早已采用血琼脂加金黄色葡萄球菌划线的方法分离及用“卫星试验”鉴定Hi[7]。但杂菌生长等因素影响了Hi分离率。在我们以往的试验中,也观察到血琼脂加金葡菌划线法的分离率为12.5%[8],较ICCA法为低。即使在某些营养培养基中加入Ⅴ、Ⅹ因子成分,Hi的生长亦非最好。Rennie等[2]对GC琼脂、普通巧克力琼脂、Columbia琼脂、Brucella琼脂、BHIA、MHA琼脂等6种Hi培养基,作进一步的组方配伍分析,认为GC琼脂加1%的酵母浸膏及5%脱纤维羊血加热巧克力化(GCYSB),GI值最高,且其他细菌的生长受限制。Columbia巧克力琼脂上的Hi生长仅次于GCYSB,但其他细菌生长不受影响;BHIA及MHA添加血红蛋白和β-NAD后,菌落生长不理想,GI值低。我们的实验结果还显示,ICCA上Hi菌落最大(平均直径2.671mm),GI值为17.79±1.47,明显高于其他4种培养基;BHIA的菌落最小,GI值亦最低(4.26±0.48)。但5种培养基在较高稀释度时均观察到生长,其中ICCA、MGCYSB、MHA3种培养基在菌液稀释达10-7时仍见Hi生长,因此认为是较好的培养基。尽管MHA培养基上Hi菌落生长不理想(平均直径为1.570mm),仍不失作为美国NCCLS推荐的Hi试验专用培养基[4]。
我们研制的ICCA培养基通过对临床878份呼吸道标本进行培养,在急性呼吸道感染的患者中,Hi检出率为23.3%,与国内外报道相似[8~10]。因此,我们认为,ICCA培养基是一种价格适宜、配制方便,临床应用价值高的Hi选择性培养基,有望在基层实验室普及推广。
作者简介:修清玉,女,1954年9月生,教授,硕士生导师
作者单位 修清玉 赖国祥 王桂芳 方 正 陈吉泉 罗文侗 第二军医大学长征医院呼吸内科,上海,200003
参考文献
1 李仲兴,郑家齐,李家宏主编. 诊断细菌学. 北京:黄河文化出版社(香港),1992. 641
2 Rennie R,Gordon T,Yaschuk Y, et al. Laboratory and clinical evaluation of media for the primary isolation of Haemophilus species.J Clin Microbiol,19 92,30(8):1917
3 邓光贵,张文俊,陶红群. 改良GCYSB培养基分离流感嗜血杆菌的应用评价. 临床检验杂 志,1995,13(3):115
4 王 辉,陈民钧,徐英春. 简要介绍美国NCCLS药敏纸片扩散法规(续)(1993年12月版). 中华医学检验杂志,1995,18(1):60
5 吴丽华,徐培元,周 弟. 流感嗜血杆菌培养基及培养条件的研究. 中华医学检验杂志,1994,17(3):187
6 Anesty RJ,Gun-Munro J,Rennie RP,et al. Laboratory and clinical evaluation of modified New York City media (Henderson formulation)for the isolation of Neisseria gonorrhoeae.J Clin Microbiol,1984,20(5):905
7 Chapin KC,Doern GV.Selective media for recovery of Haemophilus influe nzae from specimens contaminated with upper respiratory tract microbial flora. J Clin Microbiol,1983,17(6):1163
8 赖国祥,罗文侗,修清玉,等. 社会获得性急性下呼吸道感染流感嗜血杆菌分离培养. 第二军医大学学报,1997,18(1):82
9 郭品娥,凌代文,张永生,等. 提高痰中流感嗜血杆菌阳性分离率的方法. 中华医学检验杂志,1994,17(2):102
10 Burman LA,Trollfors B,Audersson B,et al. Diagnosis of pneumonia by cultures,bacterial and viral antigen detection tests,and serology with special reference to antibodies against pneumococal antigens.J Infect Dis,1991,163(5):1087