耐氨苄西林流感嗜血杆菌产β-内酰胺酶机制研究
第二军医大学学报1999年第20卷第10期
束学安 罗文侗 修清玉 戴旭明
摘 要 目的:探讨耐氨苄西林的流感嗜血杆菌产生β-内酰胺酶的机制。方法:对临床分离的112株流感嗜血杆菌耐药菌用纸片法作β-内酰胺酶测定,用PCR法检测产酶流感嗜血杆菌中的β-内酰胺酶基因的存在。结果:纸片法测得产酶菌株32株,产酶率28.6%(32/112);32株产酶菌中PCR法测β-内酰胺酶基因阳性菌株29株,阳性率为90.6%(29/32),其中质粒DNA模板组阳性为25株,基因组DNA模板组阳性为4例。结论:(1)流感嗜血杆菌耐氨苄西林主要由质粒介导产生β-内酰胺酶所造成。(2)PCR法是研究流感嗜血杆菌是否携带β-内酰胺酶基因及该基因所在位置的简便而有效的方法。
关键词:嗜血杆菌,流感 β-内酰胺酶 抗药性,微生物
自1972年第一次发现流感嗜血杆菌因产β-内酰胺酶而致耐氨苄西林以来[1],国外对耐氨苄西林流感嗜血杆菌的耐药机制以及产β-内酰胺酶的分子基础研究,呈逐年增加趋势。1978年Bryan等[2]首次报道了质粒介导产生β-内酰胺酶的流感嗜血杆菌。此后,围绕流感嗜血杆菌中的质粒编码β-内酰胺酶及其与耐氨苄西林的关系进行了许多研究。我国由于流感嗜血杆菌的分离率较低,对此问题的研究一直没有深入。本文作者在本实验室成功提高流感嗜血杆菌分离率的基础上[3,4],分离获得36株耐氨苄西林的流感嗜血杆菌,用纸片法测定它们产β-内酰胺酶的情况后,用PCR方法对产酶菌中β-内酰胺酶基因的存在与否进行了检测,对耐氨苄西林的流感嗜血杆菌产生β-内酰胺酶机制作了初步分析。
1 材料和方法
1.1 流感嗜血杆菌的分离培养 收集痰或咽拭子标本,于1 h内接种于改良的哥伦比亚巧克力琼脂平板中,置5% CO2孵箱,37℃孵育18~24 h,对疑似流感嗜血杆菌的菌落分别于血琼脂和营养琼脂平板上作卫星试验,仅在血琼脂平板上卫星试验阳性者为流感嗜血杆菌。用常规的纸片法(K-B法)对每个菌株作体外药物敏感试验,根据美国NCCLS标准判读药敏结果。从平板上挑取耐氨苄西林的单菌落接种于含3 ml液体HTM培养液的试管中,于5% CO2孵箱37℃孵育培养过夜,离心收集菌体用于质粒制备等后续实验。
1.2 纸片法测定β-内酰胺酶 将流感嗜血杆菌培养物经超声裂解后直接涂布于β-内酰胺酶纸片上,在15 min内变红者为阳性。超声仪为Branson Sonifier 250,β-内酰胺酶纸片购自Oxid公司。
1.3 PCR法检测β-内酰胺酶基因
1.3.1 PCR引物 针对β-内酰胺酶结构基因的PCR引物由本校分子遗传学开放实验室用PCGENE软件PCRPLAN程序设计,上海生工生物工程公司协助合成。引物序列为:上游引物:5′TGGGTGCACGAGTGGGTTAC3′,下游引物:5′TTATCCGCCTCCATCCAGTC3′。
1.3.2 PCR反应条件 用PE2400型DNA扩增仪,50 μl PCR反应体系中含有模板DNA 1 μl、上游下游引物各1 μl(浓度为25 μmol/L),10×缓冲液5 μl,dNTP混合物(10 mmol/L)4 μl,并用ddH2O补足至50 μl(Mg2+的终浓度为1.5 mmol/L),以94℃ 3 min→(94℃ 1 min→55℃ 1 min→72℃ 1 min,循环30次)→72℃ 7 min→4℃保温。PCR反应后取10 μl产物点样,进行琼脂糖凝胶电泳并拍照。
1.3.3 PCR模板的制备 细菌质粒DNA用常规碱裂解法分离、RNase Ⅰ消化、酚/氯仿抽提纯化[3];细菌基因组DNA用菌体冻融法制备:取少量细菌于1.5 ml塑料离心管中,用蒸馏水重悬,加入少量溶菌酶于37℃水浴5 min,放入液氮迅速冰冻5 min,取出后立即放入37℃水箱融化5 min,重复冻融3次,室温下1×104 r/min离心5 min,吸取上清液到新的离心管,加入1.5倍体积的无水乙醇于-20℃沉淀30 min,1.5×104 r/min离心沉淀,用10 μl TE溶解后备用。
2 结 果
2.1 流感嗜血杆菌的分离 自1997年10月至1998年11月,从我院呼吸内科及耳鼻咽喉科呼吸道感染患者中收集634份痰及咽拭子标本,分离鉴定出112株流感嗜血杆菌,其中,药敏试验证明为氨苄西林耐药的36株。
2.2 β-内酰胺酶检测结果 36株耐氨苄西林流感嗜血杆菌中,纸片法测得产酶菌株32株,耐药菌中产酶率88.9%(32/36)。
2.3 PCR法检测β-内酰胺酶基因结果 用针对β-内酰胺酶基因的上游和下游特异性引物扩增后,阳性条带大小为486 bp,扩增结果与预期值相同(图1)。32株产酶菌中PCR阳性菌株29株,阳性率为90.6%。其中以质粒为模板PCR阳性菌株25株,占产酶菌的78.1%(25/32);对7株质粒DNA模板PCR阴性的菌株,以基因组DNA为模板进行PCR扩增,结果有4株为阳性(图2)。

1 质粒DNA模板PCR扩增β-内酰胺酶基因的部分结果
fig 1 Results of PCR amplification of β-lactamase
gene with plasmid DNA template
M: Ⅶ marker from Borhinman Co.; Line 1~3,5,7:
Positive; Line 4,6,8,9: Negative
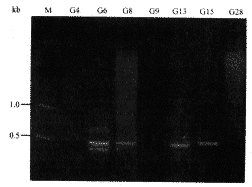
2 质粒DNA模板PCR阴性菌的基因组DNA模板PCR扩增结果
fig 2 PCR results amplified with genomic DNA
template isolated from PCR negative strain
with plasmid DNA template
M:2 000 marker from TAKARA Co.; Line G6,G8,G13
and G15 : Positive; Line G4,G9 and G28: Negative
3 讨 论
国外对耐氨苄西林流感嗜血杆菌产β-内酰胺酶的分子机制研究,主要采用的方法是在大量培养细菌的基础上,通过CsCl密度梯度超离心等方法获取较大量的质粒DNA,进行限制性内切酶酶切分析、琼脂糖凝胶电泳、质粒转化试验等,大致分析质粒DNA的大小、结构,验证质粒介导的耐氨苄西林表型等,获得质粒介导的产酶及其与耐氨苄西林药物的关系等的可靠证据[6]。但是,自然状态的流感嗜血杆菌菌株中所携带的野生型质粒的大小、结构、拷贝数差异非常大,对细菌培养的数量、质粒抽提纯化的方法提出了很高的要求,其结构的变异也造成电泳、酶切分析等方法难以做到精确分析质粒的结构。另外,野生型质粒的分子量通常较大,常用的转化实验成功率不高;再加上野生型菌株中所含质粒结构复杂,而这些方法都未能直接鉴定质粒DNA中是否携带有编码β-内酰胺酶的基因。
鉴于上述情况,本实验设计了针对β-内酰胺酶基因的特异性引物,对所分离获得的产β-内酰胺酶的耐氨苄西林流感嗜血杆菌中该酶编码基因的存在情况进行了直接的PCR检测。结果发现,32株产β-内酰胺酶的流感嗜血杆菌,用可靠的碱变性法获取的质粒DNA为模板进行PCR检测,阳性率达到78.1%,而7株质粒DNA模板PCR阴性的产酶菌株中,有4株在以染色体DNA样品为模板进行的PCR反应中表现阳性。这些结果提示耐氨苄西林的流感嗜血杆菌编码β-内酰胺酶的基因主要存在于所携带的质粒DNA上,而有少部分酶基因位于染色体DNA上,这与文献报道的结论一致。从方法上看,本研究所采用的PCR法直接检测耐氨苄西林流感嗜血杆菌中β-内酰胺酶基因的方法,特异性高,标本产β-内酰胺酶的核苷酸序列具有高度的特异性;敏感性高,PCR方法可将待测DNA片断的量扩大百万倍,可以检测细菌含量极微的标本;既可以测质粒模板β-内酰胺酶基因,也可以测染色体模板β-内酰胺酶基因;如果配合PCR产物的序列测定等,还可用于β-内酰胺酶分类、基因序列分析、分子流行病学调查等。但PCR方法有假阳性的情况,如β-内酰胺酶基因结构出现变异但未影响PCR引物结合位点时,可能存在PCR阳性但基因并无活性的情况。从理论上讲,能产生β-内酰胺酶的菌株均应有相应的编码基因存在,但本实验中有3株PCR阴性,可能的原因是模板制备过程以及PCR反应过程所造成的假阴性所致。虽然国外有用PCR方法检测流感嗜血杆菌菌株、β-内酰胺酶基因及其分类的报道[7],国内袁艺等[8]曾用PCR法检测流感嗜血杆菌菌株,但对产β-内酰胺酶的耐氨苄西林流感嗜血杆菌,分别以其质粒DNA和染色体DNA为模板,用PCR方法测β-内酰胺酶基因,研究其产酶和耐药机制的,国内外均未见报道。
文章编号:0258-879X(1999)10-0770-03作者单位:第二军医大学长征医院呼吸内科,上海,200003;
戴旭明:第二军医大学基础医学部医学分子遗传学开放实验室
参考文献
1 Gunn BA, Woodall JB, Jones JF, et al. Ampicillin-resistant haemophilus influenzae[J]. Lancet. 1974,2(7884): 845
2 Bryan LE. Transferable chloramphenicol and ampicillin resistance in a strain of Haemophilus influenzae[J]. Antimicrob Agents Chemother, 1978,14(1):154
3 修清玉,赖国祥,王桂芳,等. 改良哥伦比亚巧克力培养基分离流感嗜血杆菌[J]. 中华医学检验杂志, 1998,21(3):161
4 方 正,罗文侗,修清玉,等,流感嗜血杆菌下呼吸道感染的实验与临床研究[J]. 中华结核与呼吸杂志, 1999,22(4):208
5 萨姆布鲁克 J, 弗里奇 EF, 曼尼阿蒂斯 T. 金冬雁,黎孟枫 译. 分子克隆实验指南. 第2版[M]. 北京:科学出版社,1992. 19~24
6 Bajanca-Lavado MP, Casin I, Vaz-Pato MV. Antimicrobial resistance and epidemiological study of Haemophilus influenzae strains isolated in Portugal. The Multicentre Study Group[J]. J Antimicrob Chemother, 1996, 38(4):615
7 Tenover FC, Huang MB, Rasheed JK, et al. Development of PCR assays to detect ampicillin resistance genes in cerebrospinal fluid ample containing Haemophilus influenzae[J]. J Clin Microbiol, 1994, 32(11): 2729
8 袁 艺,卢 竞,郭章溉,等. 聚合酶链反应技术检测流感嗜血杆菌[J]. 中华微生物学与免疫学杂志, 1997,17(1):25