冠状动脉粥样硬化性心脏病患者脂蛋白酯酶基因的单核苷酸多态性的初步研究
中华医学遗传学杂志2000年第17卷第3期
苏智广 张思仲 侯一平 张立 廖林川 夏庆杰 肖翠英 孟海英 颜有仪
摘 要 目的 探讨脂蛋白酯酶基因(lipoprotein lipase, LPL)单核苷酸多态性(single nucleotide polymorphisms, SNP)与冠状动脉粥样硬化性心脏病(简称冠心病)的关系。方法 利用聚合酶链反应扩增110名健康人和102例冠心病患者LPL基因第6外显子和第6内含子的片段,采用温度调控高效液相色谱技术对扩增的片段进行了筛查,对筛查到的杂合片段进行序列测定,并与正常序列进行对照分析。结果 在LPL基因第6内含子中发现了3个尚未报道的SNP(4212t/c、4509t/c、4576a/c)。它们的频率在被检测的冠心病患者和健康人群中存在差异,其中4212 t/c、4576 a/c两组间差异显著(P<0.05)。结论 补充了LPL基因SNPs的数据库信息。LPL基因SNPs的研究可能对冠心病等复杂疾病机理的认识有重要价值。
关键词:脂蛋白酯酶基因;单核苷酸多态性;温度调控高效液相色谱;DNA序列分析;冠状动脉粥样硬化性心脏病
脂蛋白酯酶基因(lipoprotein lipase,LPL)是由脂肪细胞、心肌细胞、骨骼肌细胞、乳腺细胞及巨噬细胞等实质细胞合成和分泌的一种酰基甘油水解酶,可将极低密度脂蛋白和乳糜微粒中的甘油三酯水解为分子量较小的脂肪酸[1]。LPL基因是一个长度约为30 kb的单拷贝基因,人LPL基因定位于8p22上,由10个外显子和9个内含子组成[2]。LPL基因内存在广泛的多态性,它们有的分布在转录调控序列中,如Yang等[3]在家族性联合高血脂症(familial combined hyperlipidaemia, FCHL)患者中发现的-93/T→G多态性;有的分布在内含子序列中,如第8内含子中C→G导致的HindⅢ限制片段长度多态性,第6内含子中C→G造成PvuⅡ限制片段长度多态性[4,5]。LPL基因外显子序列中有3个常见的引起氨基酸改变的突变(Asp9→Asn、Asn291→Ser、Ser447→X),并与血脂水平增高和冠状动脉粥样硬化性心脏病(简称冠心病,coronary atherosclerotic heart disease, CHD)的发生存在相关性[6]。我们采用温度调控高效液相色谱技术(temperature-modulated high-performance liquid chromatograph, TmHPLC)对LPL基因第6外显子和部分第6内含子的单核苷酸多态性进行了研究,就其与冠心病的相关性进行了分析,为探索冠心病发病机理提供资料。
1 对象和方法
1.1 对象 华西医科大学附属第一医院心血管内科住院部无血缘关系的冠心病患者102例,男55例、女47例,平均年龄58.4±6.5岁。疾病诊断均经冠状动脉造影证实,冠状动脉至少有一支狭窄≥50%。正常对照组为无血缘关系的健康个体110名,男67名、女43名,平均年龄57.4±4.3岁,并经询问病史、体检及心电图、胸部X线摄片等检查排除心血管疾病历史。
1.2 方法
1.2.1 基因组DNA的提取 取冠状动脉造影手术患者血液5 ml,以ACD抗凝,用饱和氯化钠法提取血液白细胞DNA[7],4℃保存备用。
1.2.2 PCR扩增 PCR引物根据Genebank AF050163公布的序列设计,由中国科学院上海细胞生物学研究所合成,引物序列P1:TGCACAGGA-CTATATCCTTGG;P2:AACAGAAACACCAGG-GCTCAG;P3:TTGCCAGGAGTTTGTTTCACTT;P4:ACCTCTATACCACGAAAGACACC;P5:ATC-AGGCAATGCGTATGAG;P6:GTTGTGAACTTC-TGATAACAATCT。引物P1与P2扩增第6外显子(509),引物P3和P4(238 bp)、P5和P6(464 bp)分别扩增第6内含子的片段。
PCR扩增条件为:94 ℃预变性180 s,94 ℃变性30 s,54~60 ℃退火60 s,72 ℃延伸60 s,循环30次。最后于72 ℃额外延伸10min。扩增产物经1.5%琼脂糖凝胶电泳分析,在紫外灯下观察DNA带,拍照,记录。
1.2.3 温度调控高效液相色谱(TmHPLC)检测 TmHPLC在HP公司的HPLC仪上进行。流动相的组成为,缓冲液A:100 mmol/L三乙基乙二氨四乙酸(triethylamine acetate,TEAA),pH7.0, 0.1 mmol/L乙二氨四乙酸(EDTA);缓冲液B:25%乙腈(acetonitrile),100 mmol/L TEAA,pH7.0。
1.2.4 测序分析 为证实TmHPLC检出的杂合子的碱基改变,当TmHPLC检测出现杂合子吸收峰时,作测序分析。将PCR产物与T-载体进行体外重组,用重组DNA转化E.coli,筛选阳性克隆,对阳性克隆扩大培养,提取质粒。测序试剂盒为Usb公司的耐热测序酶循环测序试剂盒(thermo sequence cycle sequencing kit)。质粒DNA 6 μl,加入4 μl试剂盒反应液,在PE9600热循环仪上进行测序反应。首先96 ℃加热6min,然后经94 ℃45 s,55 ℃ 45 s,72 ℃ 1min,循环40周期。测序反应结束后,在ALP express DNA自动测序仪(Pharmacia公司)上完成测序电泳和DNA序列分析。
2 结果
2.1 SNP的TmHPLC筛查 当LPL基因该区域存在SNP的标本,在TmHPLC图上可见杂合子色谱峰(图1)。
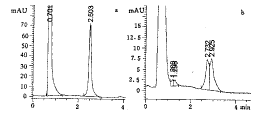 图1 LPL基因第6外显子和第6内含子的TmHPLC检测图 a:单一色谱峰表示纯合子;b:杂合子色谱峰;x轴表示洗脱时间(min),y轴表示DNA的260 nm吸收度,图左的色谱峰是PCR产物中残留的dNTP和引物
图1 LPL基因第6外显子和第6内含子的TmHPLC检测图 a:单一色谱峰表示纯合子;b:杂合子色谱峰;x轴表示洗脱时间(min),y轴表示DNA的260 nm吸收度,图左的色谱峰是PCR产物中残留的dNTP和引物
fig 1 Chromatograms of TmHPLC analysis in exon 6 and intron 6 of LPL gene a:a single peak corresponding to homoduplex molecule was detected in homozygotes; b:double peak was seen in heterozygotes. The x axis represents time in minutes, the y axis is a measure of absorbency(microvolts). The first large deflection toward the left of each chromatogram is due to residual dNTP and primers from PCR
2.2 测序结果 将TmHPLC筛查到有杂合子的DNA片段进行DNA测序分析,发现了LPL基因内3个尚未见文献报道的SNP位点,它们是4212 t/c、4509 t/c、4576 a/c,图2代表4212 t/c的测序结果。
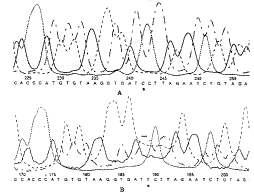 图2 LPL基因第6内含子测序结果 4212位点存在SNP T→C;A:杂合子测序结果;B:正常对照;*:SNP碱基
图2 LPL基因第6内含子测序结果 4212位点存在SNP T→C;A:杂合子测序结果;B:正常对照;*:SNP碱基
fig 2 Sequence analysis of intron 6 of LPL gene A:sequence electrophoregram of DNA strand demonstrating SNP for T→C; B:sequence electrophoregram of DNA strand demonstrating homozygous T; * base of SNP
2.3 LPL基因第6内含子的序列变异在患者和正常人群中的分布见表1。由表1可见,这些位点在冠心病患者和正常健康人群中的分布频率存在差异,关于差异与临床表型及各项生化检测指标的关系分析见另文报告。
表1 LPL基因第6内含子序列变异的分布
table 1 Distribution of sequence variants in intron 6 of LPL gene
| Groups(组别) |
No. of
subjects(例数) |
Genotype(基因型)(%) |
| 4212 |
4509 |
4576 |
| t/t(野生型) |
t/c(杂合型) |
t/t(野生型) |
t/c(杂合型) |
a/a(野生型) |
a/c(杂合型) |
| Controls(正常人) |
110 |
100(90.90) |
10(9.10) |
105(95.40) |
5(4.60) |
110(100) |
0 |
| CHD(冠心病患者) |
102 |
81(79.41) |
21(20.59) |
90(88.20) |
12(11.80) |
94(92.10) |
8(7.90) |
CHD group vs control group:4212 t/c,4576a/c(P<0.05);4509t/c (P>0.05)[CHD组与对照组比较:4212 t/c,4576a/c(P<0.05);4509t/c (P>0.05)]
3 讨论
SNP数量大、分布广,在人类30亿碱基中有约3×106个SNP位点,在任何已知或未知疾病基因附近都可能找到众多的SNP。因此,SNP可作为研究基因组多态性和识别、定位疾病相关基因的一种工具。如应用高密度的SNP图谱,通过相关分析或连锁分析来定位一系列多基因疾病,如糖尿病、高血压、哮喘、癌症等的主基因[8]。理论上任何用于检测单碱基突变或多态的技术都可用于SNP的识别和检出,但传统的基于电泳和荧光标记的方法如RFLP、OLA、SSCP等样本处理费时费力,且效率不高。Oefner等[9]发展了变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC)筛查SNPs的方法,Underhill等[10]应用该方法筛查了Y染色体的SNPs。用DHPLC筛查SNP的优点是:(1)效率高,O′Donovan等[11]采用双盲分析法证明在他们研究的基因中DHPLC法可100%地筛查出SNP;(2)检测的DNA片段大小范围较宽,我们采用TmHPLC筛查了238 bp、464 bp、509 bp等大小的DNA片段;(3)省时,可自动化操作,而且不需要对PCR产物进行任何后处理,可直接将其放入自动进样器用来进样;(4)重现性好,分析DNA样品的整个过程可以在优化条件下完全而精确地重复。
通过TmHPLC筛查杂合子的关键因素是洗脱温度,选择合适温度的过程也是TmHPLC中最费时的步骤,网站http://locta. stanford. edu/dhplc/可提供基于PCR产物碱基组成的预测温度。我们所研究的DNA片段的洗脱温度见表2,可见最佳温度较推荐值浮动1~3℃。
表2 DNA洗脱温度
table 2 The temperature for TmHPLC
| Fragment(DNA片段) |
Size(bp)
(大小) |
TmHPLC temperature(℃)
(TmHPLC温度)(℃) |
| Experimental(实验值) |
Predicted(预测值) |
| Exon 6(外显子6) |
509 |
61 |
57-59 |
| Intron 6(内含子6) |
238 |
59 |
54-59 |
| Intron 6(内含子6) |
464 |
62 |
56-63 |
Nickerson等[12]采用PCR产物直接测序法,研究了来自美洲、欧洲、欧美等对冠心病易感程度不同人群LPL基因的变异,在9. 7 kb的区域发现了79个SNPs和9个插入-缺失变异。我们采用TmHPLC技术对LPL基因第6外显子和第6内含子中的片段进行了筛查,将筛查到的杂合子进行了测序分析,在第6内含子中发现了3个尚未见文献报道的碱基置换,它们在冠心病患者和正常健康人群中的分布频率存在差异,这些碱基变异位点是否可作为LPL酶活性改变的标记,还有待进一步深入研究。
基金项目:国家自然科学基金重大项目(39993420)
通信作者:张思仲(E-mail:zszg@wcums.edu.cn)
作者单位:苏智广(610041 成都,华西医科大学附属第一医院医学遗传研究室)
张思仲(610041 成都,华西医科大学附属第一医院医学遗传研究室)
夏庆杰(610041 成都,华西医科大学附属第一医院医学遗传研究室)
肖翠英(610041 成都,华西医科大学附属第一医院医学遗传研究室)
侯一平(法医学院)
廖林川(法医学院)
孟海英(法医学院)
颜有仪(法医学院)
张立(心血管内科)
参考文献
[1]Eckel RH. Lipoprotein lipase, a multifunctional enzyme relevant to common metabolic disease. N Engl J Med, 1989, 320∶1060-1068.
[2]Oka K, Tkalcevic GT, Nakano T,et al. Structure and polymorphic map of human lipoprotein lipase gene. Biochem Biophys Acta, 1990, 1049∶21-26.
[3]Yang WS, Nevin DN, Peng R, et al. A mutation in the promoter of the lipoprotein lipase (LPL) gene in a patient with familial combined hyperlipidemia and low LPL activity. Proc Natl Acad Sci U S A, 1996, 524.
[4]Jemaa R, Fumeron F, Poiriwe O, et al. Lipoprotein lipase gene polymorphism:associations with myocardial infarction and lipoprotein levels.J Lipid Res, 1995∶2141-2146.
[5]Cole SA, Aston CE. Association of a Pvu Ⅱ RFLP at the lipoprotein lipase locus with fasting insulin levels in Hispanic men. Genet Epidemiol, 1993, 177.
[6]Humphries SE, Nicaud V, Margalef J, et al. Lipoprotein lipase gene variation is associated with a paternal history of premature CAD and fasting and postprandial plasma triglycerides. Arteroscler Thromb Vasc Biol, 1998, 18∶526-534.
[7]Miller SA, Dykers DD, Polesky HF. A simple salting out procedure for extracting DNA from nucleated cells. Nucl Acid Res, 1988, 16∶1215.
[8]Collins FS, Guyer MS, Chakravarti A. Variations on a theme:cataloging human DNA sequence variation. Science, 1997, 278∶1580-1581.
[9]Oefner PJ, Underhill PA. Comparative DNA sequencing by denaturing high performance liquid chromatography. Am J Hum Genet, 1995, 57∶A266.
[10]Underhill PA, Jin L, Mehdi SQ, et al. Detection of numerous Y chromosome bialleic polymorphisms by denaturing high performance liquid chromatography(DHPLC). Genome Res, 1997, 996-1105.
[11]O′donovan MC, Oefner PJ, Roberts SC, et al. Blind analysis of denaturing high performance liquid chromatography as a tool for mutation detection. Genomics, 1998, 44-49.
[12]Nickerson DA, Taylor SL, Weiss KM, et al. DNA sequence diversity in a 9.7 kb region of the human lipoprotein lipase Gene. Nature Genetics, 1998, 233-240.